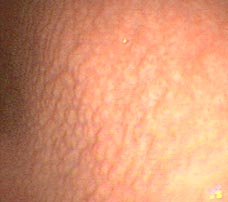
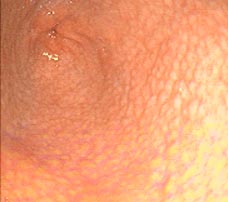
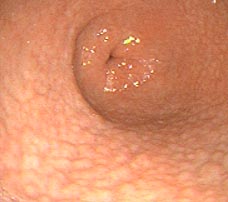
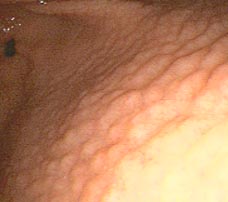
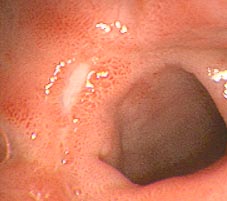
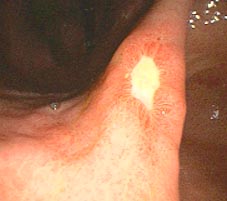
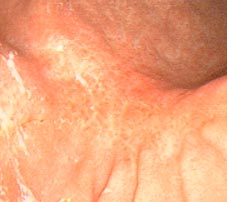
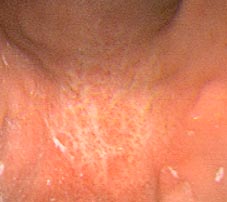
1.- INTRODUCCIÓN Y OBJETIVO
Desde siempre los estudios biológicos se han centrado
en conocer las condiciones en que pueden desarrollarse los seres
vivos, y como ejemplos sencillos los siguientes: estudios de las
temperaturas, las concentraciones de oxígeno, las presiones
atmosféricas, los nutrientes, etc. de su habitat adecuado;
y desde el punto de vista de su homeostasis interna, se ha mostrado
la importancia del equilibrio hidroeléctrico y ácido-básico
de sus estructuras celulares, conociéndose que para el
buen funcionamiento de las mismas, y sobre todo en los humanos
se considera indispensable la presencia de un pH adecuado y casi
neutro, situación que obedece a pautas universales ya establecidas,
en donde se toleran desviaciones mínimas corregibles por
mecanismos internos o por ayudas externas. Pero también
se acepta que las nociones básicas del conocimiento biológico
y por supuesto con evidencias científicas, dichas nociones
pueden ser sacudidas y obligadas a modificar lo establecido, y
estar preparadas para aceptar que pueden aparecer nuevos horizontes,
que ya existían, pero no identificados en relación
a condiciones extremas, en donde la presencia de seres vivos no
fuera posible, pero que sí existen. Sin duda se aceptó
siempre que la vida celular del organismo humano implica la necesidad
de un pH alrededor de 7, interno y externo, por lo que por extensión
y deducciones lógicas, se aceptó que por la acidez
de la secreción gástrica con pH de 1.5, el medio
era necesariamente destructor de microorganismos y casi se le
consideró como un medio estéril
y sólo modificable por circunstancias patológicas,
que abatieran la acidez como en las gastritis crónicas
y con atrofias de la mucosa, en donde un ambiente menos ácido,
si permite o facilita la presencia de bacterias e incluso hongos
( 1 ).
Pero se presentó un hecho histórico, un descubrimiento
científico que cimbró el ambiente científico
de la medicina, de la bacteriología y sobre todo de la
gastroenterología y de otras ciencias, y que fue la demostración
indiscutible de que en el estómago y sobre la mucosa gástrica,
viven bacterias que colonizan y lesionan
al epitelio y afectan a toda la economía. El aporte científico,
indiscutible, contundente de la presencia de cepas bacterianas
en la mucosa gástrica, preparadas para tolerar condiciones
extremas de pH de 2 o menos, colonizar y llenar por lo menos dos
de tres posibilidades en las relaciones de un hospedero (cuerpo
humano y su estómago) y de un huésped (bacteria),
comensalismo, parasitismo o simbiosis, lo dieron los investigadores
australianos Barry Marshall patólogo-biólogo y Robin
Warren gastroenterólogo-clínico, en 1982 que identificaron
y cultivaron una bacteria, gram negativa, microaerofílica,
de forma espiral y cuya colonización y desarrollo en la
mucosa gástrica, representa un factor etiopatogénico
indiscutible para ocasionar dispepsias , gastritis, úlceras
duodenales y gástricas, procesos linfoproliferativos parecidos
a los linfomas e incluso ser un factor facilitador de adenocarcinoma
( 2, 3 ). A esta comunicación científica se le reconoce
como uno de los fenómenos extraordinarios de las investigaciones
biomédicas modernas y que su bacteria la de Marshall y
de Warren, ocupara un papel protagónico en el interés
progresivo de investigadores de todo el mundo, en diversos campos:
clínico, bacteriológico, de anatomía patológica,
epidemiológico, farmacológico, inmunológico,
genético, etc. como lo demuestra el hecho de que basta
solicitar en un servidor de internet información sobre
las palabras Helicobacter pylori, para que la repuesta inmediata
sea de miles de publicaciones en los últimos 25 años,
e incluso de que la bacteria tenga el privilegio de una publicación
propia y exclusiva ( 4 ).
El descubrimiento mencionado, dado a conocer no en revistas
científicas australianas ( la sociedad de gastroenterología
de Australia no aceptó el informe prelimina en forma de
carta ) sino por la revista LANCET, en donde su cuerpo editorial
se interesa por el hecho fundamental y con base científica,
de que por primera vez se tuvieran las evidencias de que las gastritis
y las úlceras pépticas, pudieran tener una etiología
infecciosa y por supuesto recibir tratamiento con antibióticos.
Esta posibilidad al principio no fue aceptada fácilmente
ya que desde el principio del siglo XIX, se asoció a la
enfermedad ulcerosa péptica gastroduodenal, a factores
etiopatogénicos directos o primarios como el ácido
gástrico en pacientes hipersecretores (dogma: no ácido
no úlcera ) y al estrés vinculado a una vida angustiante
dando forma a teorías psicosomáticas y a factores
secundarios como el alcohol, tabaquismo, medicamentos, alimentos
irritantes, el café, e incluso se habló por años
de personalidad y predisposición familiar ulcerogénica,
pero hasta antes de 1982, no se pensó en una etiología
bacteriana ( 5, 6 ).
Pero los investigadores australianos, no sólo dieron un
papel protagónico a la bacteria Helicobacter pylori, sino
que también nuevamente se lo dieron a la mucosa gástrica
en relación a sus funciones secretoras, hormonales y nerviosas
con la producción del ácido clorhídrico en
situaciones normales, de hipersecreción y las formas de
disminuirlo. Las investigaciones llevaron a sus autores a tres
premios Nobel, uno a principios del siglo XX en 1904 año
en que el galardonado fue I. P. Pavlov, por sus investigaciones
en relación a la estimulación neuro-refleja de la
secreción del ácido gástrico. El segundo
premio fue para el investigador J. W. Black, que siguiendo los
conceptos de L. Popielski de que la histamina estaba involucrada
en la estimulación de la secreción del ácido
gástrico, tuvo el mérito de identificar los receptores
H2 de antagonistas de histamina; el descubrimiento de los antagonistas
de los receptores H2, y su utilidad en el control de la secreción
gástrica y de la cicatrización de las úlceras
pépticas, fue considerado un avance científico sensacional.
Después el importante descubrimiento de los más
poderosos inhibidores de la bomba de protones de las células
parietales gástricas ( IBP ) y de alta efectividad en la
aceleración de la cicatrización de las úlceras
pépticas, no fue motivo de de merecer un premio Nobel,
por lo que el tercer premio y adjudicado en el año de 2005,
fue para Marshall y Warren en fisiología y medicina por
sus descubrimientos y aportaciones sobre Helicobacter pylori,
y su relación causal en patologías gastroduodenales
( 7 ).
Actualmente se conoce que el Helicobacter pylori es el responsable
de la infección bacteriana crónica mas común
en el mundo, estimándose que la prevalencia está
por arriba del 50 %, y aún cuando este microorganismo esta
presente en gran parte de la población mundial, no se le
ha podido considerar como un microbiota habitual, por el hecho
de que su presencia siempre produce una respuesta inflamatoria
en grado variable de los infectados, lo que representa un verdadero
problema de salud, que es diferente para países desarrollados
con prevalencias que varían en cifras de 5 al 10 %, en
comparación con las reportadas en países en desarrollo
con cifras que alcanzan hasta el 90 %, como es el caso de los
países de Africa y de latinoamérica, includo México
( 8 ). En relación a estas diferencias los factores que
más se mencionan son: el nivel socioeconómico y
el de salud ambiental ( 9 ).
Por lo mencionado esta revisión, pretende como objetivo,
el que represente un documento de información, fácil
de leer, dirigido a estudantes de medicina y que sea una ayuda
para el ejercicio profesional de los médicos generales
y de primer contacto, con la intención de que se interesen
en el tema de la infección crónica por Helicobacter
pylori, como un problema de salud nacional, que se justifica por
la alta prevalencia, que supera la cifra de 70 % de infectados
en México. Por lo que para mitigar las consecuencias de
dicha situación, es necesario el esfuerzo de todos los
involucrados en la atención de asistencia médica
y en trabajos de prevención de todos los días, y
comprometerse para que en México se logre alcanzar el nivel
de país desarrollado en salud ambiental y para todos.
2.- HISTORIA
Sin duda la asociación entre Helicobacter pylori con las
gastritis fue observado por primera vez por Warren en 1979, y
la bacteria cultivada hasta 1982, pero la historia del microrganismo
tiene múltiples antecedentes que se remontan a la importante
época de la caza de microbios de los finales del siglo
XIX y principios del XX, y de los mencionados unos más
que otros son los siguientes:
-
En 1875 Bottcher y Letulle investigadores
alemanes descubren una bacteria en la base y en los bordes de
úlceras gástricas, y sugieren como hipótesis
que la bacteria puede ser causa de la enfermedad ulcerosa, pero
como no pudieron cultivar a la bacteria, la información
no fue motivo de atención y fue olvidada ( 6 ).
-
En 1893 Bizzozero identifica bacterias de
forma espiral en la mucosa gástrica de perros, infiltrando
las glándulas e incluso dentro del citoplasma y vacuolas
de las células parietales; dicho organismo fue nombrado
despues Helicobacter bizzozeroni en 1996.
-
En 1896 Salomon describe la misma bacteria
en el estómago de ratas (en otras publicaciones se menciona
que fue en gatos ).
-
En 1899 Walery Jaworski en Cracovia estudiando
aspirados gástricos de humanos, describió bacterias
alargadas de forma espiral, a las que denomino Vibrio regula,
siendo el primer investigador en informar la posible participación
de este microorganismo en las enfermedades gástricas,
y aún cuando el estudio fue incluido en un libro de gastroenterología,
no tuvo la difusión que merecía por que se publicó
en polaco ( 7 ).
-
En 1906 Krienitz( otras publicaciones lo
nombran Karientz ) encuentra bacterias espirales en la mucosa
de de estómagos de pacientes que tuvieron cáncer.
-
En 1921 Edkins describe la presencia de
Helicobacter felis en gatos. ( descubrió a la gastriana
en 1905 )
-
En 1938 la asociación entre espiroquetas
e inflamación gástrica en monos macacos es descrita
por Doenges; este autor reportó también la presencia
de dichos microorganismos en el 43 % de estómagos humanos
estudiados en necropsias.
-
En 1940 Freedberg y Barron “ confirmó
“ que las espiroquetas descritas por Doenges no tienen
un papel etiológico en las enfermedades gástricas
del hombre.
-
Pero también en el mismo año
Gorham postuló la hipóteis de que una “
bacteria acidófila “ era la causa de úlceras
gástricas ( 9, 10 ).
-
En 1979 Robin Warren identifica una bacteria,
estudiando las biopsias gástricas de un paciente con
gastritis crónica activa, iniciándose en dicho
año la era del Helicobacter pylori; las investigaciones
del patólogo Robin Warren continuan estudiando biopsias
de de pacientes con gastritis, describiendo bacterias en forma
de espirales localizadas entre la capa mucosa y la superficie
del epitelio, y durante dos años confirma dicho hallazgo;
pero su mérito lo representó sin duda el asociar
la presencia de la bacteria como posible factor etiológico
o causal de alteraciones inflamatorias de grado variable de
la mucosa gástrica del hombre. En 1981 el gastroenterólogo
clínico Barry Marshall confirma y apoya los descubrimientos
del patólogo, y en 1982 logran el cultivo de la bacteria
del moco obtenido de once pacientes con gastritis demostradas
también en biopsias, y lo contrario la ausencia de bacterias
en biopsias de estómagos de pacientes normales. En 1983
ambos autores comunican sus observaciones, con estudios histopatológicos
y tinciones de plata y al germen lo denominan Campilobacter
pyloridis y después Campilobacter pylori ( corrigiendo
la gramática latina ). Ese mismo año logran identificar
al bacilo en el cultivo de moco gástrico, hecho que en
múltiples comunicaciones lo denominan como fortuito,
por tratarse de un cultivo olvidado por varios días (
10 ).
-
En 1985 Barry Marsall para demostrar la
patogenicidad de la bacteria, se autoinfecta ingiriendo una
cepa de bacilos cultivada y obtenida de un paciente de 66 años
con diagnóstico de dispepsia no ulcerosa, y a las dos
semanas tiene la misma sintomatología manifestada por
crisis de dolor en epigástrio, nauseas y vómitos,
se le realiza endoscopia y en las biopsias de su propia mucosa
gástrica se identifican los bacilos; en unas publicaciones
se describe que curó espontáneamente ( 11 ) y
en otras que recibió tratamiento con sales de bismuto
y metronidazol ( 12 ). Independientemente a estas dos aceveraciones,
lo importante del mismo hecho, lo representa la contundencia
de la comprobación de haber cumplido los postulados relacionados
a los padecimientos de origen infeccioso.
-
En 1987 Morris también ingiere el
bacilo que le ocasiona gastritis requiriendo tratamiento con
un antibiótico para lograr su erradicación ( 13
).
-
En 1989 en la 2ª Reunión del
Grupo Europeo para el estudio del Campilobacter en Ulm Alemania,
y por estudios filogenéticos y del ADN bacteriano se
concluyó que el género debería ser el de
Helicobacter, reconociéndose además como la única
bacteria relacionada con las gastropatías, y cuya diferencia
principal con el campilobacter es la de que el Helicobacter
es una bacteria que tiene flagelos en uno de los extremos en
número variable de cuatro a ocho ( 9 ).
-
La clasificación aceptada:
Reino: Bacteria
Clase: Proteobacteria
Orden: Campilobacterales
Familia: Spirillaceae,
Género: Helicobacter
Especie: pylori
-
Por la demostración inobjetable de
múltiples estudios posteriores, se conoció que
la presencia de la bacteria es a nivel mundial, que la mayoría
de las personas infectadas permanecen asintomáticas,
pero que en una proporción variable que puede ser de
un 10 % a 20 % , sin duda, la infección es causa de gastritis
aguda , gastritis crónica persistente, gastritis atrófica,
úlceras duodenales y úlceras gástricas;
además y que ha sido la preocupación mayor, es
de que los adultos infectados y no tratados, tienen de dos a
seis posibilidades de riesgo para desarrollar neoplasias gástricas
como adenocarcinoma y tumores parecidos a los linfomas. Con
los años se ha demostrado su asociación con padecimientos
extragástricos ( 14, 15, 16, 17, 18 ).
-
La demostración contundente de que
el Helicobacter pylori es un factor etiológico en las
gastritis, las úlceras gástricas y duodenales,
es de que se curan con esquemas de erradicación bacteriana
a base de antibióticos y de que las recidivas de las
úlceras pépticas han disminuido notablemente,
como también han disminuido las indicaciones de cirugía
( 19 ).
-
Con los años se ha conocido que los
tratamientos de erradicación del Helicobacter pylori
ha dado grandes beneficios, han disminuido las úlceras
pépticas, pero se ha manifestado una situación
que amerita ser aclarada, y es la del aumento de la enfermedad
por reflujo gastroesofágico, el diagnóstico frecuente
de epitelio de Barret y del aumento del adenocarcinoma de la
unión esofagogástrica ( 19, 20 ).
3.- LA BACTERIA
El Helicobacter pylori es una bacteria gram negativa, curva, espiriforme,
muy móvil, no fermentadora, no oxidante que mide de 2.5
a 4 micras de longitud por 0.5 a 1 micra de ancho, con un mechón
de flagelos en uno de sus extremos en número de 4 a 8 envainados
y que le dan gran movilidad; la forma espiral es más evidente
cuando se le identifica en las biopsias, pero cuando se le identifica
en los cultivos la morfología es más recta y se
aprecian bacterias que han perdido sus flagelos; además
de que se han descrito formas redondas como cocos, habiéndose
postulado tres posibilidades: una de que son formas de resistencia
implicadas en la transmisión, que son formas viables pero
no cultivables, o de que son formas de bacterias muertas. Como
bacteria gram negativa, comparte características estructurales
de ellas, como son la presencia de una membrana plasmática
y una membrana externa; su composición interna se caracteriza
por un complejo constituido por elementos fibrilares nucleares
y ribosomas, que se entremezclan entre sí, pudiendo mostrar
en ocasiones bacteriófagos; como hecho importante es de
que la vaina de sus flagelos tiene una estructura lipídica
exactamente igual a la de la membranan externa, con la misión
de proteger a los flagelos de la degradación del ácido
( 9 ). El H pylori se cultiva en preparaciones de agar, es de
crecimiento lento, necesitando un medio microaerófilo con
concentraciones de O2 de 2 % a 8 % y de CO2 de 7 % a 10 %, lo
que muestra que requiere concentraciones de O2 menores a las atmosféricas,
necesitando además hidrógeno y metanogénesis
como fuente de energía; los medios de cultivo selectivos
enriquecidos necesitan nutrientes ( Campy Bap, el de Dent, medio
para cultivo de Brucela, de Skirrow, etc. ) y los más mencionados
son: peptona, triptona, extractos de levadura, glucosa, sales
como cloruro de sodio, bisulfito de sodio, con 1 % a 10 % de sangre
de carnero, de caballo y/o suero fetal bovino, en un pH de 6.6
a 8.4 y temperaturas de 33 a 40.5 grados centígrados (
9 ). Para el desarrollo se necesita por lo menos seis días
de incubación, identificándose colonias pequeñas,
transparentes y muy similares a las colonias de Camplylobacter,
facililitándose la identificación, mediante la tinción
de las colonias, utilización de reacción de catalasa
y de citocromoxidasa positivas y demostrando la acción
de ureasa, que rapidamente desdobla a la urea en pocos minutos.
Esta prueba es definitiva, ya que no existe otro aislamiento bacteriano
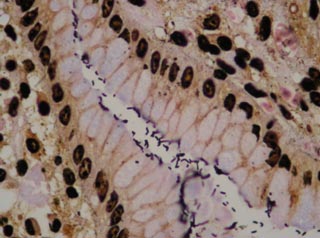
de la mucosa gástrica, similar al Helicobacter pylori productor
de ureasa ( 21 ).
Las dos características fundamentales de la bacteria
para lograr un habitat natural en la mucosa gástrica humana,
es la de ser la infección bacteriana crónica mas
frecuente y extendida y solo superada por el problema de las caries
dentarias, y la de mostrar una enorme capacidad de adaptación
a la acidez de la superficie gástrica, para lograr un micronicho
de colonización permanente. Esto se debe a que dentro de
sus genes destaca el que permite la producción a gran escala
de una enzima vital y que es la ureasa, enzima que se localiza
en la superficie de la bacteria, que con el cofactor níquel
catalizan la hidrólisis de urea en bióxido de carbono
y en amonio que rodea a la bacteria, como un halo
o nube protectora que neutraliza el ácido
gástrico, elevando el pH de 1.5 a 6 o 7 en el entorno bacteriano,
y situarse entre el espesor de la capa de moco y la superficie
epitelial, en donde el pH es neutro. La bioquímica de la
enzima ureasa revela una extraordinaria eficacia hidroeléctrica
que le permite actuar aún con las escasas concentraciones
de urea que existe en el estómago; además, en el
año 2000, se describió una proteina que fue nombrada
ure1 , miembro de las amidoporinas, que regula la transferencia
de urea externa del epitelio gástrico, hacia el citoplasma
de la bacteria, mediante canales o compuertas transportadores
específicos que atraviesan la membrana celular, de tal
manera que cuando el medio externo es excesivamente ácido,
los canales incrementan notablemente la entrada de urea al citoplasma
bacteriano, aumentando la producción de amonio para neutralizar
el periplasma ( area delimitada por las dos capas de la membrana
celular bacteriana ); sin la capacidad de la bacteria para llevar
a pH neutro al propio periplasma, el microorganismo se hace vulnerable
al pH ácido, representando así, el mecanismo extraordinario
de adaptación, defensa y sobrevivencia ante condiciones
extremas ( 1 ); además, si el pH gástrico se alcaliniza
por efecto de una comida, la urea no entra al citoplasma, no es
desdoblada por la ureasa, evitándose un posible efecto
letal alcalino sobre el H pylori. La ureasa es una enzima con
alto peso molecular de 600,000 KDa, habiéndose descrito
dos subunidades denominadas A y B con pesos moleculares de 33,000
y 66,000 KDa respectivamente, que se activan a pH de 4 a 10 con
óptimo de 10 ( 9 ). El H pylori produce otras enzimas como
catalasas, proteasas, oxidasas, fosfolipasas, hemoaglutininas,
adhesinas que permiten entender su patogenicidad ( 22 ). La adaptación
del H pylori al estómago humano por siglos, se ha logrado
por su capacidad de desarrollar el mecanismo de neutralizar el
ácido gástrico , y como se ha mencionado por la
producción de la enzima ureasa, pero también por
su capacidad de regular dicha producción e incluso incrementarla,
por la capacidad que tiene la bacteria de producir N- metilhistamina,
lo que sugiere mecanismos reguladores del pH del micronicho de
colonización de acuerdo a sus necesidades; por estas capacidades
se ha mencionado que la infección gástrica por la
bacteria podría representar una asociación benefica,
ya que ante la posibilidad de aumentar la producción de
ácido y desde el punto de vista preventivo, se disminuiría
la posibilidad de entrada de bacterias enteropatógenas
al estómago y que no están preparadas para sobrevivir
en el médio hostil gástrico ( 23 ).
En la actualidad se conocen múltiples especies de Helicobacter
asociados a la mucosa del tracto digestivo de otros hospederos,
y actualmente las listas llegan por lo menos a 24 especies de
HELICOBACTER descritas en forma válida, y existe otro número
importante en espera de ser identificadas formalmente. ( 9, 10
). Las especies más nombradas son: el H acinonyx aislado
de la mucosa gástrica de chitas, H mustelae de hurones,
H nemestrinae de monos macaco, H suis de cerdos, H bizzozeronii
de perros, H felis de gatos, etc. pero la única especie
involucrada en patologías del estómago humano es
el H pylori y que tiene gran variedad de cepas ( 24 ).
4.- EPIDEMIOLOGÍA
En veinticinco años de haberse demostrado la colonización
bacteriana de la mucosa gástrica humana por el H pylori,
se conoce por estudios principalmente de prevalencia, que la infección
es de distribución mundial, y de que indiscutiblemente
se puede adquirir desde la infancia, en relación a dos
factores fundamentales y de efecto inversamente proporcional y
que son el nivel de desarrollo de los diferentes países
y los niveles de sanidad del medio ambiente de los mismos, y como
en otra patologías, a la infección por H pylori
se le califica como indicador de pobreza. Para los países
en desarrollo y con condiciones no óptimas de sanidad,
para sus poblaciones se reportan frecuencias en forma de tasas
o coeficientes a base de prevalencias muy altas de infección
en sus infantes, con cifras hasta de 70 % a 80 %; en cambio en
países desarrollados y con condiciones sanitarias óptimas,
la prevalencia en su población infantil es de sólo
0.5 % a 1 % para menores de diez años; en general se reporta
una prevalencia para todas las edades y a nivel mundial con cifras
que promedian aproximadamente 50 % o más como se aprecia
en los siguientes dos tablas ( 22 ).
| TABLA
1 INFECCIÓN POR H pylori A NIVEL MUNDIAL |
| CONTINENTE |
% |
| MÉXICO, AMERICA CENTRAL Y AMÉRICA DEL SUR |
70 % - 90 % |
| AFRICA |
70 % - 90 % |
| ASIA |
70 % - 80 % |
| EUROPA ORIENTAL |
70 % |
| EUROPA OCCIDENTAL |
30 % - 35 % |
| CANADA Y USA |
30 % |
| AUSTRALIA |
20 % |
| TABLA
2 PREVALENCIA DE HELICOBACTER pylori EN PAÍSES EN
DESARROLLO EN ADULTOS E INFANTES |
| CONTINENTE |
PAIS |
ADULTOS
(>21) % |
INFANTES
% |
AFRICA |
ETIOPIA |
>95% |
48% (2-4) a 80% (6) |
| GAMBIA |
>95% |
95% (5) |
| NIGERIA |
91% |
82% (5-9) |
ASIA |
BANGLADESH |
>90% |
58% (0-4) a 82% (8-9) |
| CHINA |
>55% |
41% (3-12) |
| INDIA |
88% |
22% (0-4) a 87% (10-19) |
| SIBERIA |
85% |
30% (5) a 63% (15-20) |
| SRI LANKA |
72% |
67% (6-19) |
MEDIO ORIENTE |
EGIPTO |
90% |
50% (3) |
| JORDANIA |
82% |
¿ |
| LIBIA |
94% |
50% (1-9) a (10-19) |
| ARABIA SAUDITA |
80% |
40% (5-9) |
| TURQUIA |
80% |
64% (6-17) |
| AMERICA DEL NORTE |
MEXICO |
70% |
43% (5-9) |
| AMERICA CENTRAL |
GUATEMALA |
65% |
51% (5-10) |
| AMERICA
DEL SUR |
BOLIVIA |
¿ |
54% (5) |
| BRASIL |
82% |
30% (6-8) a (10-19) |
| CHILE |
72% |
36% (3-9) |
| PERU |
¿ |
52% (3) |
La edad, la etnia y el género son factores que pueden influir
en la incidencia y en la prevalencia de la infección por
H pylori, pero los que sí las influyen sin duda, lo representa
el estado socioeconómico, mencionándose lo representado
por situaciones de hacinamiento, la promiscuidad, la vivienda
sin servicios básicos, agua de dudosa calidad en lo referente
a la potabilización o francamente contaminada, el nulo
control de calidad higiénica en el manejo de alimentos
y la desnutrición, hablando de países en desarrollo.
Esto también se manifiesta en países desarrollados,
como es el caso de EEUU, en donde las diferencias entre poblaciones
de blancos con prevalencias de menos del 10 % en caucásicos
menores de 30 años, para alcanzar cifras de 50 % en los
mayores de 60 años, comparadas con sus poblaciones de origen
africano, indígenas autóctonos y latinoamericanos,
en donde sin duda todos estos grupos tienen mayores prevalencias
y desde la infancia por una alta transmisión intrafamiliar,
por nivel socio-económico bajo y todo lo que esto representa,
sobre todo en los grupos inmigrantes recientes con cifras de mas
de 60 % en los mayores de 60 años ( 21, 22 ). Los estudios
epidemiológicos y que son numerosos se han basado principalmente
en valores de prevalencia, demostrándose no solo diferencias
en relación a países desarrollados y en desarrollo,
sino también diferencias por continentes, entre los diversos
países que los integran, además de que en cada uno
de estos, las diferencias son evidentes por zonas, citadinas de
mejor calidad de vida, zonas márginadas de las grandes
ciudades y por supuesto en las rurales. Por ser una infección
tan extendida y de distribución mundial, los factores de
riesgo pueden variar no solo en países sino entre poblaciones,
por lo que un factor de riesgo ( como es el nivel socioeconómico
o el nivel de sanidad ambiental ) se ha utilizado y facilitado
los estudios de grandes grupos , para determinar prevalencias
y no para incidencias, ya que para conocer incidencias, se necesitan
estudios de cohorte y se puedan estimar efectivamente otros factores
de riesgo para adquirir la infección ( 25 ). Esto se demuestra
sin duda en el estudio de infección por H pylori, y en
cualquier país en desarrollo en donde al investigar grupos
de poblaciones cerradas, como en asilos de enfermos mentales,
orfanatos, reclusorios, áreas marginadas y muy confinadas,
a los factores de riesgo indudables socio-económicos y
de bajo nivel de sanidad, se agregan otros bien estudiados y siempre
se mencionan: promiscuidad, hacinamiento, situaciones de nacimientos
en vivienda, niveles de escolaridad y sobre todo dificultad o
nulo acceso a agua potable. Como resultado
de estos informes y haberse demostrado que es una infección
de distribución mundial, se acepta actualmente que la transmisión
de la bacteria se ocurre de persona a persona, que es entre familiares,
de madre a hijo, por vias oral-oral, oral-fecal y oral-aguas contaminadas,
por lo que la prevalencia en niños a nivel mundial se estima
en 30 %, con cifras de seroprevalencia o seroconversión
de 24 % entre los 3 y 5 años, para llegar al 45 % en edades
de 16 a 20 años ( 9,10, 26, 27 ).
En México la comunidad médica no podía mantenerse
al margen del impacto que representó el descubrimento de
Warren y Marshall, y las publicaciones han alcanzado también
número altamente significativo, en relación a conocer
los aspectos epidemiológicos y las características
de la infección en la República; los múltiples
trabajos y altamente significativos, se han centrada en estudios
de prevalencia en infantes, en adolescentes, y en poblaciones
de todas las edades, por lo que algunos trabajos y a partir de
la última década del siglo XX, algunos han sido
de consulta y referencia obligadas y representan un ejemplo de
la producción académica de las grandes instituciones
de atención del sector salud nacional. Como primer ejemplo
el trabajo de Torres publicado en el J. Infect. Dis. En 1998 sobre
la sero-epidemiología e infección por H pylori en
México; el estudio iniciado en 1997, se efectuó
con sueros representativos de la población de todos los
estados de la República Mexicana; muestra que incluyó
a 11, 605 sueros y procedentes de personas con edades de 1 a 90
años; en sus resultados se advierte que el 20 % de los
niños de 1 año de edad mostraron anticuerpos para
H pylori, que la sero-positividad aumentó progresivamente
a cifras de 50 % en niños de 10 años, lo que demuestra
el hecho ya aceptado a nivel mundial, que la infección
en México como país en desarrollo también
se adquiere desde la infancia, alcanzando cifras de 80 % en la
población joven con edades de 18 a 20 años, y de
que la seropositividad aumenta un 5 % cada año de los primeros
10 años de vida ( 28 ). Lagunes reportó la prevalencia
de H pylori en infantes en edad escolar de 6 a 13 años
y sanos de la ciudad de Puebla, mediante la investigación
de antígeno de H pylori en materia fecal en 46 de género
masculino y 48 del femenino, detectándose resultados positivos
en 13 niños y en 10 niñas con una prevalencia de
24 %, sin diferencias en el género; la autora considera
la necesidad de dar seguimiento a esta población de infantes
portadores asintomáticos, para conocer el momento y el
comportamiento o no de sintomatología; sus cifras que se
acercan a las reportadas en países desarrollados, como
en Austria cuya población infantil de 6 a 10 años
muestran una prevalencia de 28.3 % , y se alejan de las reportadas
en países en desarrollo como Brasil cuya población
de 10 años muestran una prevalencia de 48.8 % ( 29 ). Constanza
en 2004, estudia la sero-prevalencia de H pylori en 5861 adolescentes
del estado de Morelos, reportando una sero-prevalencia general
de 47.6%, correspondiendo al 40.6 % en preadolescentes de 11 a
14 años, de 48.6 % en adolescentes de 15 a 17 años
y de 59.8 % en adultos jóvenes con 18 a 24 años
de edad; lo que muestra que la sero-prevalencia se influye con
la edad e inversamente a los niveles socioeconómicos, como
es la realidad de los paises en desarrollo ( 30 ). Calva Rodríguez
en el 2006, reportó la prevalencia de H pylori, mediante
la búsqueda de antígeno en heces fecales, en tres
grupos de niños provenientes de tres medios socioeconómicos
diferentes de la ciudad de Puebla: grupo A integrado por 94 de
un medio socio-económico calificado de medio-bajo y de
zona conurbana, el B por 94 del medio rural y el C integrado por
94 de un medio socio-económico alto, niños que asisten
a escuelas privadas y viven en zonas citadinas con todos los servicios
sanitarios. En el A 23 fueron positivos ( 24.46 % ), en el B 17
positivos ( 18.08 % ) y en el C sólo 2 dieron resultado
positivo ( 2.12 % ), mencionando que la sola presencia de drenaje
intradomicilario y la presencia de carne en la dieta de los niños
representó significancia estadística entre los tres
grupos; el tener acceso a agua potable y el número de personas
que viven en la misma casa, si prevalecieron estadísticamente
en los grupos A y B, lo que está de acuerdo a lo reportado
a nivel mundial ( 31 ). Goodman estudió la epidemiología
de la infección por H pylori en mujeres embarazadas controladas
en una clínica de atención materno-infantil de la
ciudad del Paso Texas de U.S.A. y de atención del Instituto
Mexicano del Seguro Social de la ciudad de Juárez Chihuahua,
investigando condiciones de sanidad del medio ambiente y la detección
de anticuerpos séricos para H pylori; en una muestra de
751 sueros reportó una seroprevalencia de 74 % paras las
mujeres de la ciudad del lado de la frontera de México,
y de 56 % para las de la ciudad del lado de U.S.A.; concluyendo
que las altas prevalencias de infección en mujeres embarazadas
atendidas en ambas zonas fronterizas, se derivan de deficientes
condiciones de sanidad, hacinamiento en la vivienda y pobres situaciones
socioeconómicas, que son más evidentes del lado
mexicano de la frontera ( 32 ). Mohar en 2001, estudió
la prevalencia de lesiones precursoras de adenocarcinoma gástrico
asociadas a la infección por H pylori en la población
de Comitan del estado de Chiapas, en donde las altas prevalencias
de infección por H pylori y de adenocarcinoma gástrico
representan un problema de salud para dicha entidad federativa;
en su revisión incluyó 281 personas asintomáticas
con estudios serológicos positivos de anticuerpos y para
la citotoxina CagA del H pylori, a todos se les efectuó
endoscopias y biopsias para identificar a la bacteria y las alteraciones
de la mucosa gástrica; destaca la alta frecuencia de lesiones
precursoras de adenocarcinoma gástrico en una población
asintomática, pero con evidencia de positividad serológica
de infección por H pylori por cepas CagA ( + ); solo en
el 10.7 % no se pudo identificar al H pylori en las biopsias,
en el 59 % se encontró gastritis crónica activa,
un 51 % de metaplasia intestinal de tipo completo, un 12.5 % de
displasia moderada o severa, sin identificarse casos de displasia
grave, pero sí se identificó un caso de carcinoma
in situ. La frecuencia de lesiones precursoras de adenocarcinoma
gástrico, fueron similares entre personas de 60 años
o mayores y población más joven, sin diferencias
de género. Sólo un paciente no mostró alteraciones
de la mucosa gástrica y en el 25 % de la serie se identificaron
grados variables de inflamación aguda o crónica;
lo interesante del estudio es de que se dividió a la muestra
en dos grupos, uno para tratamiento de erradicación ( N0=143
) y otro control con placebo ( N0=138 ); a las seis semanas de
selección aleatorizada, la frecuencia de erradicación
para el grupo tratado fue de 70 % y de sólo 3.6 % para
el grupo placebo. En sus conclusiones se advierte la posibilidad
de beneficios de erradicación del H pylori, como medida
de preventiva del adenocarcinoma gástrico, que como se
ha demostrado la infección crónica por H pylori,
tiene un riesgo de producir neoplasia en frecuencias reportadas
del 53 % al 60 %, abriendo una posibilidad para el control del
adenocarcinoma que en México es de alta prevalencia ( segunda
causa de muerte en pacientes que fallecen por tumores malignos
en México ), de diagnóstico tardío y de alta
mortalidad ( 33 ).
5.- ESTUDIOS GENÓMICOS
Se conoce que existen múltiples cepas del H pylori, las
que tienen una capacidad variable de mantener la infección
por toda la vida de los infectados, distinguiéndose también
por su extensa diversidad genética, originada en su capacidad
adquirida de borrar, reacomodo y mutaciones del la secuencia del
DNA; esta diversidad facilita la adapatación a nuevos hospederos
infectados, a la persistencia por años y de la alta prevalencia
de infección a nivel mundial; diversidad también
evidenciada en múltiples estudios, que han demostrado una
amplia variabilidad del genoma ( lo que se ha llamado como variaciones
genéticas mayores del H pylori ) de las bacterias que infectan
a diferentes individuos no relacionados y la menor diversidad
clonal de las bacterias de un mismo individuo y de los relacionados
por línea familiar ( 34 ). Estos conocimientos fueron consecuencia
de una amplísima información que llevó a
conocer la estructura genética del H pylori de dos cepas,
que confirman la estructura mimetizante de la bacteria, caracterizada
por altas frecuencias de mutaciones; la cepa conocida con el numeral
26695, fue aislada en el Reino Unido en 1987 en un paciente con
gastritis, y la cepa conocida como J99 se aisló en Estados
Unidos de Norteamércia en un paciente con úlcera
duodenal; ambas cepas no tienen un origen de replicación
identificables, pero se conoce que tienen una longitud promedio
de secuencias codificables de 1590 marcas de lectura abierta para
la cepa 26695 y de 1495 para la J99, representando el 90.8 % y
el 91 % de sus genomas respectivamente. El H pylory es una bacteria
que se caracteriza por su enorme diversidad genética, y
en la mayoría de los genes del H pylori, las secuencias
de los nucleótidos observados muestran una variación
de 3 % a 5 %; además las diferencias en las secuencias
de los nucleótidos de los genes individuales, derivan de
numerosas mutaciones puntuales ( microdiversidad ), habiéndose
demostrado también diferencias en la organización
de los genes ( lo que se conoce como macrodiversidad ); esta variabildad
de los genes es una característica única del H pylor,
en comparación con otras bacterias gram negativas. La bacteria
es altamente competente para captar ADN, que permite recombinaciones
genéticas entre las cepas, dando lugar a poblaciones con
estructura genética recombinante y genes organizados en
forma de mosaico ( 35, 36 ).
6.- PATOGENICIDAD
Se tienen evidencias de que existen diversas especies de H pylori,
que se comportan como flora nativa del estómago de diferentes
mamíferos, pero el H pylori es habitante exclusivo del
estómago de los humanos, estando presente como infectante,
por lo menos desde hace cien mil años o más, lo
que hace suponer que huesped y hospedero han evolucionado juntos
con importante implicaciones que sólo se conocieron desde
1982. La colonización bacteriana del hospedero, afecta
el epitelio gástrico a través de lograr micronichos,
utilizando recursos que se pueden considerar como señales
para el hospedero, el cual también produce señales
para la bacteria en forma de temperatura, medio químico
y por supuesto moléculas de defensa; aun cuando estas señales
recíprocas pueden ser incoordinadas, la evolución
compartida implica un encadenamiento, en donde las señales
de ambas partes tienen respuestas recíprocas. Si como se
conoce que la colonización se puede dar por diferentes
cepas y que es el caso del H pylori, que muestra el ejemplo extremo
de alto grado de mutaciones y muy alta frecuencia de recombinaciones
genéticas, lo habitual es que un hospedero no sea colonizado
por un simple o único clon, sino por un racimo de bacterias
estrechamente relacionadas, semejando a las cuasiespesies
observadas con RNA viral persistente como en el caso de la hepatitis
C y del VIH. Esta variación bacteriológica afecta
las señales del hospedero, y como ejemplo dentro de una
población bacteriana, las células individuales pueden
o no expresar moléculas de interacción específica
con el hospedero, y que afectan la biología del hospedero
de manera diferente. Como consecuencia las señales del
hospedero se muestran desde un aumento de nutrientes a través
de efectores inmunes, hasta cambios en el ambiente microscópico
gástrico y que son selectivamente diferenciados para genes
específicos del H pylori. Por lo tanto cada hospedero es
colonizado por una combinación de genes bacterianos, con
un genotipo dominante determinado por selección. En suma
la alta plasticidad de la población bacteriana sujeta también
a la selección específica del hospedero, parece
representar una explicación para tratar de entender la
facilidad con que la infección por H pylori persista por
años, con la presencia de diferentes cepas y con variantes
de dichas cepas en un hospedero individual, y la capacidad de
la bacteria de colonizar a todos los humanos a pesar de la heterogenicidad
racial ( 37 ). Durante años el H pylori al ser ingerido
por un nuevo hospedero, ha logrado establecerse en la interfase
muy delgada presente entre la capa de moco y la superficie del
epitelio gástrico, iniciándose una selección
temprana por señales inmediatas recíprocas de parte
del epitelio y de la bacteria, lo que lleva a una ocupación
que se podría calificar de estable del micronicho, y posibilidades
de transmisión a nuevos hospederos ( 38 ).
6.1.- CAPACIDAD DEL HELICOBACTER pylori PARA MANTENER
INFECCIÓN PERISTENTE
El hecho de que los infectados estén colonizados por una
población bacteriana muy versátil, por la presencia
de elementos genéticos móviles por su capacidad
de mutaciones endógenas y acciones recombinantes, modificaciones
o rearreglos cromosomales a gran escala ( que explican diferencias
a nivel de genotipo e incluso a nivel de fenotipo ), que les da
capacidades para responder a señales del microambiente
de los micronichos, que favorecen la emergencia de cepas seleccionadas,
y el mejor ejemplo, y que se conoció desde el inicio de
los esquemas de tratamiento, es la aparición de resistencias
a antibióticos y al metronidazol ( 22, 23 ). Esto se explica
por la capacidad y alta competencia que han mostrado las cepas
para tomar DNA de otras cepas, de ahí que el estudio de
secuencias de genes, muestren fuertes evidencias de recombinaciones
entre cepas, hasta el grado de que lo que se podría llamar
el linaje clonal es altamente obscurecido. Se presentan también
substanciales recombinaciones intragenómicas, con presencia
de repetidas secuencias de DNA, borramientos, duplicaciones y
grandes disparidades dentro de una supuesta misma cepa; pero también
las cepas muestran cierta competencia en relación a que
si algún elemento genético se pierde, por alguna
acción externa, aquel se recupera de un sector de bacterias
de la población no afectada o de otra cepa. Ante la necesidad
de un sistema de reparación desproporcionado, pueden incrementarse
las frecuencias de variaciones aleatorias, pero esto también
facilita la conversión genética, la cual minimiza
la diversidad genómica de aquellos alelos presentes en
múltiples copias. Es decir que el H pylori puede tener
máximas diversidades en secuencias de genes por el efecto
de fuertes presiones selectivas, mientras se mantengan los alelos
que son indispensables y críticos para su supervivencia
y forma de vida ( 39 ). La introducción de una cepa nueva
en un hospedero bien colonizado, incrementa la diversidad en la
población bacteriana, ( variabilidad de las cepas que hace
se parezcan a cuasiespecies ), pero también la transformación
de cepas, al mismo tiempo, tiende a cierto control con la intención
de reducir la diversidad de la colonización. Se conoce
que todas las cepas de H pylori contienen múltiples sistemas
de restricción-modificación, pero rara vez dos cepas
tienen el mismo complemento, lo que representa barreras restrictivas
a las transformaciones, propiedad que puede permitir al máximo
la coexistencia de cargas de genes paralelas, mediante un lento
intercambio genético. La selección local puede añadir
diversidad genética en un estómago específico,
e incluso los micronichos gástricos aislados, son comúnmente
colonizados por poblaciones bacterianas en mosaico, con atributos
particulares, como puede ser que unas bacterias tengan máximo
acceso y ligarse a receptores locales y otras no ( 40 ).
En conclusión, los mecanismos descritos para apreciar
la diversidad genética que ha mostrado el H pylori, desde
su identificación a partir de 1982, y en forma sencilla
pueden ser los siguientes: a) mecanismos endógenos con
mutaciones que ocasionan fenotipos; b) recombinaciones que dan
repeticiones aleatorias del DNA, conversión activa de genes
y carencia de un sistema de reparación para evitar caminos
desorientados en sus genes; c) recombinaciones
intergenómicas y gran competencia natural de sobrevida;
d) micronichos selectivos que tienen restricciones para las diversas
cepas de H pylori y especificidad de ligandos a receptores específicos
( 41 ).
6.2.- EVASIÓN INMUNE POR PARTE DEL HELICOBACTER
PYLORI
La posibilidad de que una bacteria persista en un hospedero vertebrado
está representada por que evite su eliminación por
el sistema inmune, y se ha demostrado, que el H pylori es una
bacteria que ha evolucionado con los humanos, que se transmite
de persona a persona ( principalmente vía materna-hijos
), que colonizó de por vida al estómago de su hospedero,
y hubiera seguido así, sino aparecen los premios Nobel
del año 2005. Su estructura poblacional bacteriana representa
un modelo ecológico sorprendente, por el equilibrio entre
las acciones efectoras como bacteria y las respuestas del hospedero,
que permite explicar el hecho de que millones de personas se infecten
y de que solo una proporción pequeña, mencionada
en múltiples publicaciones con cifras que van del 10 %
al 20 % desarrollen enfermedad, es decir que sean sintomáticos.
Esto se ha explicado por la presencia de factores bacterianos
o huésped, y del organismo u hospedero, que modulan los
riesgos de que los menos desarrollen enfermedad; esto ha sido
el punto de interés para conocer el porque de que las mayorías
integren un sistema de tolerancia, entre las acciones agresivas
de la bacteria para su sobrevivencia, y la obligada respuesta
inmunológica que trata de evitarlas, dando la impresión
de que ambos actores se toleran, en un equlibrio dinámico,
que por años se ha demostrado sin duda, por los trabajos
que muestran la existencia de pacientes asintomáticos,
con mucosa gástrica normal a la endoscopía y con
la presencia de la bacteria en las biopsias por prueba rápida
de ureasa positiva y por estudios histológicos, como si
existiera un comensalismo o simbiosis tolerada por muchos, pero
que para algunos se rompe y se presentan procesos patológicos,
que se relacionan a inflamación crónica local (
gastritis y ulceras ), alteraciones hormonales ( gastrina, somatostatina
), oncogénesis ( adenocarcionama gástrico no cardial
y linfoma de células B de la zona marginal de tejido linfoide
asociado a mucosas, conocido como linfoma MALT ( por las siglas
en ingles ), procesos inflamatorios sistémicos extragástricos
y los problemas epidemiológicos de actualidad: la obesidad
y la diabetes, a los que México no escapa ( 42, 43 ).
Se conoce que el H pylori es un habitante nativo y específico
del hombre de por lo menos desde hace 100,000 años ( 18
), y dicha cohabitación histórica se sustenta en
que en los micronichos de colonización del epitelio gástrico
se intercambian señales, entre cepas poblacionales bacterianas
no clonales y el epitelio gástrico, por lo que ante la
presencia bacteriana, se presenta un reconociemiento inmediato
por parte del hospedero, en forma innata o adquirida, incluido
esto con la generación de anticuerpos locales y sistémicos.
Y el primer paso para asegurar la sobrevievencia de la bacteria,
y lograr una colonización prolongada y evadir la respuesta
inmune del hospedero, es el de no invadir demasiado a la mucosa
gástrica, y de que el volumen principal bacteriano se localice
adyacente a la capa mucosa ( en la delgada interface ), como parte
de evitar el ser alcanzadas por el reconociemiento inmunológico
del epitelio gástrico; pero algunas bacterias que si establecen
contacto íntimo con la superficie epitelial, logran que
algunas fracciones proteicas bacterianas, atraviesen la barrera
epitelial, estimulen a las células epiteliales, las que
mediante moléculas de reconocimiento, detecten componentes
solubles peptídicos de las bacterias, induciéndose
la activación inmediata del sistema inmune natural y adquirido.
Aunque el H pylori no es capaz de evitar totalmente la activación
inmunológica, ha logrado mecanismos que reducen el reconocimiento
de los sensores inmunes, ha logrado reducir la activación
de células inmunes y escapar a los actores de defensa,
como forma importante de asegurar la sobrevivencia. Una vez que
la persistencia de la infección y la cronicidad se ha establecido,
la estimulación inmunológica es importante y constante,
como lo demuestra la titulación también persistente
de anticuerpos ( 43 ).
6.3.- FACTORES IMPLICADOS EN LA PATOGENICIDAD DEL HELICOBACTER
pylori
La presencia del H pylori como infección sintomática
o asintomática, está en relación al polimorfismo
inmune del hospedero, a la presencia del medio ácido gástrico
y la habilidad del H pylori para colonizar un micronicho gástrico
y mostrar la virulencia de algunas cepas, lo que representa el
factor principal de patogenicidad. La diferente virulencia de
las cepas, se ha estudiado centrándose en aspectos, genéticos,
microbiológicos, inmunológicos, bioquímicos
y clínicos principalmente ( 38 ) Esto indica que para que
se manifieste patogenicidad y enfermedad como complicación
de la infección por H pylori deben interactuar factores
bacterianos y factores del organismo infectado ( 43 ).
6.4.- FACTORES BACTERIANOS
Los factores bacterianos que influyen en la patogenicidad, son
los implicados directamente en la virulencia bacteriana.
6.4.1.- UREASA
El primer factor está representado por la capacidad que
ha mostrado el H pylori para adaptarse a un micronicho hostil
mediante la acción de la enzima ureasa, que como ya se
mencionó desdobla a la urea en amonio y CO2 que neutraliza
el ácido gástrico a un pH de 6 a 7, situación
que protege a la bacteria y le permite atravesar la capa de moco
gástrico. Pero la ureasa también tiene propiedades
citotóxicas y junto al amonio, lesionan la mucosa del epitelio
gástrico, permitiendo la adhesión de la bacteria,
la obtención de nutrientes y permitir su desarrollo. Esta
enzima es capaz de estimular la respuesta humoral específica,
la quimiotáxis de monocitos, de neutrófilos y de
activar las funciones de los macrófagos ( 44 ).
6.4.2.- FLAGELOS
La bacteria por su morfología en espiral y al poseer flagelos,
tiene gran movilidad que le permite atravesar la capa mucoide,
contrarrestando el peristaltismo gástrico y llegar a adherirse
a la superficie epitelial; los flagelos están compuestos
por proteínas llamadas flagelinas, con peso molecular aproximado
de 50,000 a 60,000 KDa, y están codificas por los genes
Fla A y Fla B, que son los elementos reguladoraes de la función
de los flagelos, y su importancia radica en que las cepas carentes
de ellos no logran colonizar ( 21 ).
6.4.3.- ADHESINAS
Para la colonización por la bacteria debe presentarse primero
una adhesión al epitelio gástrico, lo cual se efectúa
mediante hemaglutininas, varias adhesinas, que son proteínas
glicoconjugadas o por lípidos bacterianos involucrados
en el proceso de colonización. Las adhesinas que se mencionan
por unos u otros autores y con frecuencia son: BabA, SabA, OMP´S,
Hopo, AlpA, AlpB, Hpa; la adhesina que más ha sido estudiado
y caracterizado es la BabA, que es una proteina de membrana con
características similares a las que se observan en los
antígenos sanguíneos Lewis B ( 23 ). Las adhesinas
bacterianas al acoplarse a los receptores de las células
del hospedero, inducen cambios inmediatos mediante señales
de transducción, permitiendo la infiltración de
células inflamatorias, pero también estableciendo
mecanismos para evadir la respuesta inmune y establecer lo ya
mencionado como infección persistente ( 19 ).
6.4.4.- FOSFOLIPASAS
También existen enzimas como las fosfolipasas A2 y C de
membrana externa, que actuan como proteasas, y tienen un papel
fundamental en la patogénia del H pylori, al degradar el
complejo lípido-gluco-protéico de la capa de gel
de moco que cubre a las células epiteliales gástricas,
y que son los que les dan continuidad y protección ( 21
).
6.4.5.- LIPOPOLISACÁRIDOS
Otro factor de virulencia es el lipopolisacárido LPS, que
posee en su antígeno “O” los carbohidratos
de Lewis “x” y Lewis “y” o ambos, y cuyo
papel fundamental en la patogénesis, es evadir la respuesta
inmune durante la colonización del epitelio gástrico,
favoreciendo la persistencia bacteriana en el micronicho, equilibrando
la acción de inducir la respuesta autoinmune del hospedero
contra los antígenos Lewis que expresa el H pylori ( 10
). También se ha reportado que el lipopolisacárido
( LPS/endotoxina ) de la bacteria tiene una actividad biológica
baja comparada con el LPS de otras bacterias gram negativas, y
al poseer antígenos semejantes a los de los grupos sanguíneos
de Lewis, como parte de las cadenas de carbohidratos en la región
polisacárido de su LPS, se ha sugerido que al compartirse
antígenos comunes entre bacteria y hospedero, permite al
agente patógeno evadir la respuesta inmune, o por lo menos
no estimularla a niveles peligrosos para su supervivencia. Actividad
parecida la tienen las llamadas proteinas de choque térmico
o de choque por calor descritas como groEL y groES de peso molecular
de 58 y 13 KDa respectivamente, y que también tienen la
capacidad de aumentar la actividad de la enzima ureasa ( 40, 41
).
OTRAS ENZIMAS.- El H pylori produce otras enzimas que favorecen
la virulencia de la bacteria como mucinasas, lipasas, proteasas,
catalasas, dismutasas, que protegen a la bacteria de metabolitos
tóxicos, secundarios a procesos oxidativos de defensa de
los macrófagos y neutrófilos; también produce
fosfatasa alcalina y ácida y gamaglutamiltranspeptidasa
( 9, 10 ).
CITOTOXINAS.- A pesar de los millones de personas que se encuentran
colonizadas por el H pylori y de que sólo una proporción
de un 10 % desarrollen sintomatología, y de tratar de explicar
la paradoja del comportamiento de una
bacteria con gran capacidad de persistir en la mucosa gástrica
y sólo producir daños mínimos o muy severos,
se ha centrado en estudiar y conocer diferencias en la virulencia
de las cepas, y una de las diferencias más importante,
es la presencia o no de genes y de islas de patogenicidad ( 19,
45, 46).
6.4.6.- CITOTOXINA VACUOLIZANTE VacA
En la actualidad se conoce que todas las cepas de H pylori tienen
un gen que codifica para un toxina conocida como citotoxina vacuolizante
VacA, y que ha sido presentada como el primero de los factores
de virulencia y de gran importancia, reportada desde 1988 por
Leunk, que fue obtenida de productos sobrenadantes derivados de
cultivos; toxina que ha sido purificada, con un peso molecular
de aproximadamente 87 KDa con capacidad de inducir la vacuolización
citoplasmática en cultivos celulares y la muerte de células
epiteliales; entre sus características principal es de
que su actividad vacuolizante sólo se presenta en 50 %
a 60 % de las cepas de H pylori, a pesar de que todas tienen el
gen vacA, de que el fenómeno vaculizante es reversible,
por lo que dicha actividad no es consecuencia de efectos citotóxicos,
por lo que se habla de que no es una toxina tradicional. El gen
vacA que codifica para la citotoxina vaculoizante, no se ha identificado
como un homólogo en otras especies de HELICOBACTER o en
otras bacterias gram negativas, lo cual confiere gran importancia
en la relación específica entre el H pylori y el
estómago humano ( 47, 48 ). El gen vacA tiene una estructura
con alrededor de 1200 aminoácidos, con tres regiones: la
N-terminal, la media y la C-terminal; en la región N-terminal
se encuentra la señal de secuencias y que pueden ser los
tipos s1a, s1b, s1 y s2, y en la región media los tipos
m1 y m2. Esto es importante por que en la variación en
los tipos de las señales de secuencia de la región
N-terminal y en la secuencia media, son las que determinan la
presencia y grado de actividad vaculoizante. Las cepas con tipo
de señal de secuencia s1 en el gen si tiene actividad vacuolizante,
y la que tienen el s2 carecen de actividad; también se
conoce que las cepas que tienen la región m1 tienen más
actividad que las cepas que tienen la m2. Desde que se conoció
este hecho se pudo asociar la presencia de cepas VacA s1 / m1
con las manifestaciones patológicas gástrica más
severas y que las cepas s2 / m2, son las que dan la mayor prevalencia
para países desarrollados, en donde las patologías
asociadas son menos frecuentes ( 23 ). Se conoce que el gen vacA
está presente en todas las cepas de H pylori, pero con
la presencia de un alto poliformismo, ya que los alelos poseen
uno o dos tipos de regiones de señal, las mencionadas s1
y s2 y una o dos tipos de regiones medias m1 y m2 también
ya mencionadas lo que da múltiples combinaciones, por lo
que los estudios se han centrado en las combinaciones más
virulentas y vacuolizantes, representadas por las cepas s1 / m1.
Independientemente de que la producción de vacuolas in
vitro sea un fenómeno casi constante y no así in
vivo, lo demostrado es que las cepas que si tiene el gen con características
para producir la toxina VacA, ( principalmente proteolisis ),
que se adhiere a la membrana celular del epitelio, ocasionan la
formación de poros por los que se establece la vacuolización,
mediante el vaciamiento del contenido celular, la salida de aniones
y de urea, indispensable sustrato para la acción de la
ureasa bacteriana; la proteina VacA induce la pérdida de
las fuertes uniones epiteliales, facilitando la corriente de nutrientes
hacia los micronichos de colonización. Los estudios sugieren
que la proteina ayuda a la persisitencia del H pylori por acciones
de supresión inmunológica específica, que
impide la maduración de fagosomas en los macrófagos,
inhibiendo selectivamente la presentación antigénica
de las células T, bloqueando su proliferación y
además de controlar la respuesta inmune de tipo adaptativa
( T helper1 ) mediada por los mismos linfocitos T cooperadores,
que secretan principalmente interferon-IFN y cuyas funciones principales,
consisten en estimular las defensas por parte de los fagocitos
contra las infecciones, en especial las causadas por microorganismos
intracelulares ( 40 ) Del conocimiento de las variaciones en las
señales de secuencia s, se ha conocido la variabilidad
de cepas en relación a zonas geográficas y de grupos
étnicos ( 23 ).
GEN cagA ASOCIADO A LA CITOTOXINA CagA.- Otra
forma de explicar la baja prevalencia de sintomatología
en la mayoría de la personas colonizadas por el H pylori,
es por el conocimiento que se tuvo, de que las cepas de la bacteria
muestran grandes diferencias en su ámbito genético,
por la presencia de elementos genéticos móviles
y otras diferencias a nivel del genotipo, y del fenotipo; una
de las diferencias más importante y estudiada, es la relacionada
a la presencia o ausencia de una isla de patogenicidad denominada
cag, que se menciona como el segundo factor de virulencia y de
gran importancia desde el punto de vista de epidemilogía
y de patología. Este factor de virulencia representa un
fenotipo que diferencía a ciertas cepas de H pylori, ya
que solo el 60 % de las mismas expresan una proteina de alto peso
molecular de 120 a 140 KDa, denominada CagA . La localización
del gen cagA es crítica para expresarse, formando parte
de una isla de DNA de cerca de 40 Kb conocida como isla de patogenicidad
( cag IPA ) y que se compone por lo menos de 32 genes ( 23 ).
La isla de patogenicidad cag fue descrita en 1989 , como un gen
específico de H pylori y que rapidamente fue identificado
como marcador de cepas , que tienen la capacidad de aumentar el
riesgo de enfermedad ulcerosa péptica y de neoplasias gástricas
en los infectados; y como en el caso del gen vacA un gen homólogo
para el cagA en otras especies de HELICOBACTER, o en otras bacterias
gram negativas, tampoco ha sido identificado, lo que sugiere que
dicho gen hace sentir o es reflejo de un gen gástrico humano
específico ( 43 ). La isla de patogenicidad ( IPA ) tiene
varios genes que codifican los componentes de un aparato secretor
( sistema secretor del tipo IV, que como en otras bacterias gram
negativas Echerichia coli, Brucella suis, Bordetella pertussis
y Agrobacterium tumefaciens, logran la introducción o inyección
de macromoléculas: DNA y proteínas parecidas a la
toxina del HEMOPHILUS pertussis en las células infectadas),
y la proteina que en el caso del H pylri, se presenta como mediador
para que actúe el sistema secretor, está representado
por el producto CagA ( antígeno fuertemente inmunogénico
que desencadena la activación de interleucina IL-8 y de
factor de necrosis tumoral FNT, con la inmediata infiltración
de neutrófilos e inducción de la respuesta inflamatoria
) que es inyectado a las células epiteliales infecadas
y ya dentro del citoplasma celular, la proteina CagA es fosforilada,
reconocida y unida a un complejo de tirosina-fosfatasa, que estimula
la producción de citoxinas por la célula del hospedero,
e induce cambios en el comportamiento celular, que explican las
consecuencias que habitualmente se aprecian en pacientes infectados
por cepas de H pylori que si producen la proteina CagA y se califican
como cepas CagA positivas ( también denominadas cepas tipo
I o CagA + ) y negativas a las que no ( cepas tipo II o CagA -
). Es evidente y se ha demostrado que las cepas de H pylori CagA
+ son más virulentas, que inducen respuestas inflamatorias
más severas , que en general las cargas bacterianas de
colonización son seis veces o mayores en los antros gástricos
y producen in vivo e in vitro niveles
más altos de citotoxinas que las cepas CagA -. La asociación
entre la presencia de anticuerpos específicos para la proteina
CagA y úlcera péptica duodenal ha sido confirmada,
como que también la asociación entre la colonización
de cepas de H pylori CagA +, representan riesgos mayores para
el desarrollo de gastritis atrófica y adenocarcinoma gástrico
antral ( 47, 48 ). Se conoce que existe una importante interrelación
entre la producción de citotoxina vacuolozante VacA y la
presencia de la proteina CagA, pero que su expresión es
independiente, pero sin duda que ambas se han mostrado como factores
de virulencia específicos, que incrementan el riesgo de
desarrollar adenocarcinoma gástrico, riesgo que se aumenta
notablemente, si además existe predisposición genética
de los hospederos, como es por ejemplo la presencia de polimorfismos
proinflamatorios en varias citocinas ( 47, 48, 49 ).
Los múltiples factores de virulencia que manifiestan las
diferentes cepas de H pylori, son de máxima utilidad durante
las fases de colonización, para adjudicarse un micronicho
y asegurarse la persistencia, y son marcadores del potencial que
tienen algunas cepas, que al ser más virulentas son causa
de enfermedad, pero a diferencia de otros factores de virulencia
conocidos en otras bacterias gram negativas, a la fecha y en el
caso del H pylori, no se tienen explicaciones satisfactorias para
las sintomatologías tan proteiformes que manifiestan algunos
infectados, e incluso y en contraste a lo dicho, para los años
2000, se presentaron trabajos que mencionaron el hecho de que
la colonización por cepas de H pylori CagA +, podrían
considerarse como una marca de protección para posible
desarrollo de patologías esofágicas, específicamente
la esofagitis por reflujo y su complicación, el epitelio
de Barret ( 50, 51, 52, 53, 54, 55 ).
7.- REGULACIÓN DE LA ACTIVIDAD ÁCIDO-PÉPTICA
GÁSTRICA POR EL HELICOBACTER pylori
Después de la ingestión y de la colonización
del H pylori con predilección al antro gástrico,
situación facilitada por los mecanismos de patogenicidad
y de virulencia descritos, se va a lograr una infección
persistente, que va a durar toda la vida, propiciando una respuesta
inflamatoria y daños a la mucosa. Pero también,
la bacteria es un agente causal involucrado en modificar los mecanismos
reguladores de la secreción ácido-péptica
gástrica, alterando las relaciones entre las hormonas gastrina
y somatostatina, cambios en la motilidad antro-pilórica,
y que explican la presencia de enfermedades gastroduodenales.
Los procesos inflamatorios inducidos por las citotoxinas bacterianas,
afectan a todos los tipos celulares de la mucosa gástrica,
y por supuesto a las células involucradas en la homeostasis
de la secreción ácido-péptica, las células
D productoras de somatostatina, a las células G de la gastrina
y a las células parietales productoras de ácido;
por lo que de inicio la gastritis antral ocasiona una inmediata
reducción de los niveles de somatostatina, y como esta
hormona regula la producción de gastrina, en respuesta
inmediata se presenta una hipergastrinemia; además la producción
de gastrina puede elevarse por efecto estimulante directo de citocinas
proinflamatorias sobre las células G, de que la gastrina
es por si misma un factor de crecimento para el H pylori, ( constituyendo
un efecto de retroalimentación positivo ) efecto que se
conoce puede revertirse mediante un tratamiento de erradicación
( 9, 37 ). La consecuencia de los niveles elevados de gastrina
dependen de las areas gástricas colonizadas por la bacteria,
por lo que en una gastritis de predominio antral, las células
enterocromafines y las parietales del cuerpo gástrico no
están afectadas, por lo que a los niveles elevados y persistentes
de gastrina, corresponde un incremento de la masa de células
parietales, con aumento en la producción de ácido,
con un aumento de la carga de acidez al duodeno, que induce a
la metaplasia gástrica como efecto protector, y como el
H pylori no puede colonizar al duodeno normal, coloniza las zonas
de metaplasia, lo que lleva a la inflamación y a la clásica
ulceración péptica. Si la inflamación se
extiende al cuerpo y se manifiesta en forma de pangastritis ,
los procesos inflamatorios inducidos por la bacteria, ocasionan
una disminución importante e indirecta en la producción
de ácido, por inhibirse la producción de histamina
de las células enterocromafines, y directamente por inhibirse
las funciones de las células parietales. La reducción
en la producción de ácido ocasiona aumento en los
niveles de gastrina, niveles que no tienen respuesta en la producción
de ácido por parte de la mucosa gástrica inflamada
del cuerpo, pero si se evidencia un estímulo proliferativo
y regenerativo ascendente sobre las células epiteliales
gástricas. El efecto continuo de proliferación,
regeneración y de inflamación, afecta las características
del ciclo celular epitelial, que lleva a una pérdida progresiva
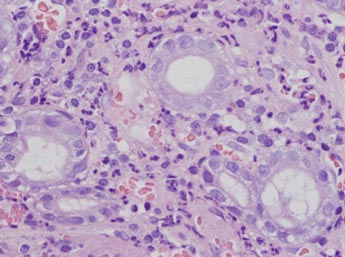
de las estructuras glandulares, a la atrofia gástrica y
a un aumento de posibilidades de formación de úlceras
pépticas gástricas y al adenocarcinoma no cardial.
También se ha insistido en mencionar que la disminución
en la producción de ácido, protege contra la ulceración
duodenal, y de que también protege de las complicaciones
inducidas por el reflujo gastroesofágico. Como argumento
a favor de esta posibilidad, se menciona el aumento considerable
de las esofagitis, que ha seguido a los tratamientos de erradicación
de la bacteria, y de que el efecto protector sería mayor
para pacientes portadores de infección por cepas de H pylori
CagA +, debido a la mayor inflamación del cuerpo gástrico,
que acelera la progresión a gastritis atrófica multifocal
( 52 ).
En resumen los mecanismos patógenos implicados y que
se enlistan con más frecuencia a los ya mencionados son:
producción de toxinas ( citotoxinas, ureasa, mucinasas,
lipasas, lipopolisacaridasas, hemolisinas, fosfolipasas, etc.
), mediadores de la inflamación por activación de
neutrófilos, de monocitos y macrófagos, estimulación
de la producción de leucotrienos, de fenómenos autoinmunes,
infiltración y degranulación de eosinófilos
y la capacidad de regular la actividad ácido-péptica
gástrica a la alta o a la baja ( 19 ).
8.- RESPUESTA INMUNOLÓGICA DE LA MUCOSA GÁSTRICA
DEL HOSPEDERO A LA INFECCIÓN POR HELICOBACTER pylori
La infección por H pylori induce una respuesta inmunológica
sistémica y a nivel de la mucosa gástrica, que son
importantes en la patogénesis, y aun cuando la producción
de anticuerpos, que se ha visto es importante, su acción
es limitada, ya que no ha conducido a la erradicación de
la infección. A pesar de los mecanismos que el H pylori
ha desarrollado para evitar o disminuir la respuesta inmune del
hospedero, esta sí se presenta y se activa desde que se
establece la infección, la que se manifiesta por respuesta
o señal de citocinas epiteliales y por infiltración
de la mucosa gástrica por neutrófilos, macrófagos
y linfocitos ( lo cual es más evidente si la colonización
se realizó por cepas CagA + ), que representa una respuesta
inmune adquirida específica, que incluye la generación
de anticuerpos, activación de linfocitos T, con respuestas
tipo Th1 ( helper 1 ) y Th2 ( helper 2 ), con predominio de la
respuesta Th1, lo cual es inusual para las bacterias productoras
de toxinas extracelulares, las cuales usualmente son confrontadas
por la activación de linfocitos B y una alta producción
de anticuerpos, y que representa la clásica respuesta inmune
tipo Th2; pero el grado de activación de la respuesta inmune
y que representa el sustento de las patologías asociadas
a la infección por H pylori, dependen de los dos factores
ya mencionados: las cepas y los factores genéticos del
hospedero, por lo que el efecto combinado de ambos factores, con
sinergismo explican los grados de patologías o que los
infectados se muestren asintomáticos ( 19 ). Esto se ejemplifica
al demostrarse que en humanos la úlcera péptica
es rara durante la supresión inmunológica con ciclosporina
y durante el embarazo, en donde las respuestas inmunológicas
tienen predominio de respuesta adaptativa tipo Th2; también
el hecho de la poca frecuencia de enfermedades gástricas
en las poblaciones africanas a pesar de la alta prevalencia de
infección por H pylori con cifras por arriba del 90 %,
en donde predomina una respuesta adaptativa de tipo Th2; se piensa
que esta respuesta disminuida parece estar inducidas por parasitosis
endémicas ( helmintiasis y paludismo constituyendo lo llamado
como enigma africano ) ( 55, 56 ).
Todavía en la literatura del año 2006 es frecuente
que se mencione que el mecanismo responsable de las manifestaciones
clínicas proteiformes, que siguen a la infección
por H pylori, no está totalmente esclarecido, como tampoco
se ha establecido un modelo teórico que explique a satisfacción
la respuesta inmune y que tiene lugar en la mucosa gástrica,
y que sigue sin duda a la invasión de la bacteria. ( 56
). Lo que se acepta es que la cepa CagA + , es la que tiene mayor
capacidad de inducir respuesta inflamatoria e inmune en la mucosa
gástrica, pero también se le ha asociado a una mejor
respuesta al tratamiento de erradicación, y que las cepas
VacA + se caracterizan por ser menos citotóxicas o patógenas
( 56 ).
Una vez que el H pylori se ha establecido en la interfase entre
la capa mucosa y el epitelio gástrico , se manifiesta la
capacidad de mediar procesos de superviviencia, ( sistema enzimático
de ureasa ) de adhesión, colonización y multiplicación,
seguidos del inicio del daño tisular localizado y mediado
principalmente por residuos de ureasa, mucinasa, fosfolipasa,
las proteinas CagA y VacA, y lo importante, que junto con el polisacárido
bacteriano y la misma ureasa, estimulan inmediatamente la respuesta
de tipo inflamatorio. La patogénesis de dicha respuesta
incluye una primera fase caracterizada por la liberación
de sustancias tóxicas, que estimulan la respuesta inmunológica
local, expresada en un aumento de la inmunoglobulina IgA ( que
representa la inmunoglobulina principal de las mucosas), con el
objetivo de impedir la infección; las principales células
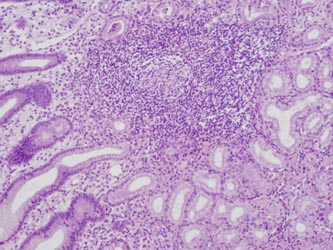
inflamatorias participantes en este proceso inicial, son los neutrófilos,
por lo que su presencia junto a folículos linfoides, son
indicativos de signo de actividad, e incluso en esta fase es frecuente
observar invasión intracelular epitelial de bacterias.
En una segunda fase se manifiesta una amplificación de
la respuesta inflamatoria, por la presencia agregada de linfocitos,
macrófagos y mastocitos, que en el sitio de lesión,
su papel es el de liberar una gran variedad de mediadores químicos,
como citocinas, eicosanoides, metabolitos reactivos de oxígeno
en forma de radicales libres de oxígeno y de activar el
sistema de complemento C, y favorecer la permanencia de la inflamación;
se menciona que en esta segunda fase también participan
neuropéptidos liberados por las neuronas del sistema nervioso
entérico, que contribuyen a ampliar la respuesta inflamatoria
y propiciar trastornos funcionales del estómago colonizado
por H pylori ( 41 ). Esta última etapa es importante en
la patogénesis de la inflamación gástrica,
resaltando la participación del sistema inmune local y
sistémico en el intento de controlar la infección
y de la neutralización de las citotoxinas bacterianas,
lo que además, potencia la destrucción hística,
la que según la duración puede llevar a la gastritis
de grado variable y la producción de úleras pépticas.
( 44, 45 ,46, ).
En la defensa del organismo frente al H pylori, se originan varias
respuestas en forma de citocinas, como la interleucina-8 ( IL-8
), que actúa como quimioatrayente en la inmunopatogénesis
de las gastritis, al atraer neutrófilos, macrófagos
y células del linaje linfoide; otra citocina como la interleucina-6
( IL-6 ) que está involucrada en la inducción de
inflamación crónica, y de la severa infiltración
de polimorfonucleares y de células mononucleares. El H
pylori es capaz de activar y promover la diferenciación
de linfocitos T0 ( helper 0 ) y en relación a las citocinas
presentes y a las condiciones inmunológicas propias de
cada individuo, se pueden diferenciar en Th1 mediando una respuesta
de tipo celular o bien Th2 con respuesta de tipo humoral. La respuesta
celular mediada a través de citocinas tipo Th1 como interferon
gama ( IFN-g ), interleucina-2 ( IL-2 ) y factor de necrosis tumoral
alfa ( FNTa ), en tanto que las citocinas de tipo Th2 como interleucina-4(
IL-4 ) e interleucina-5 ( IL-5 ) como respuesta de tipo humoral.
Se pretende reconocer como posibilidad, que la respuesta inmune
derivada de la invasión por la bacteria a la mucosa gástrica,
al parecer se realiza mediante un equilibrio entre las respuestas
de la línea celular y de la humoral, que expresan las acciones
inflamatorias características inducida por el H pylori.
Esto se hace evidente al conocerse sin duda, que algunos pacientes
manifiestan respuesta inflamatoria persistente
sin daños mayores, y otros con respuestas humorales o celulares
más agresivas que incluso llevan a desarrollar neoplasias
( 48, 57 ).
Para la respuesta celular siempre se mencionan dos mecanismos:
uno representado por la fagocitosis
y el otro por la apoptosis. La fagocitosis
se efectua mediante células mononucleares del tipo de los
macrófagos, que actúan como células presentadoras
de antígenos ( CPA ), cuya función es precisamente
presentar los antígenos del H pylori a los linfocitos T
circulantes; pero como los macrófagos no resisten el ácido
clorhídrico y los factores de virulencia y de patogenicidad
de la bacteria son extraordinariamente potentes, la fagocitosis
se ve impedida, representando una fase efectora no lo suficientemente
efectiva como para destruir a la bacteria, lo que muestra que
la respuesta inmunológica iniciada, queda sólo como
presentación antigénica, y si se producen anticuerpos
por la previa estimulación celular o de linfocitos B, también
los anticuerpos no son suficientemente efectivos para controlar
la invasión bacteriana, además, de que los anticuerpos
no tienen capacidad para atravesar la capa mucosa gástrica,
llegar a las bacterias, controlarlas y evitar más daños
( 58 ). La apoptosis o muerte celular programada, está
presente para logra estabilidad numérica celular en la
mucosa gástrica, mediante una proliferación celular
balanceada, y regulada por señales e interacciones célula-célula,
como parte de un control social que garantice que las células
individuales trabajen para el bien común del organismo
como un todo. El mecanismo de apoptisis es de tipo citotóxico
a través de linfocitos CD8+, activando caspasas ( principalmente
caspasa-3 ) y que representan un eslabón importante en
la cascada apopótica, ya que dicha proteina activa DNAsas
citoplasmáticas, que al migrar al núcleo celular
degradan el ADN cromosomal. Se ha propuesto que en la infección
por H pylori de la mucosa gástrica, al presentarse un aumento
de FNTa, por respuesta inmune de tipo celular Th1, se contribuye
a un aumento de la apoptosis celular, por aumentarse la actividad
de caspasa-3, vía de la activación de la caspasa-8.
Se conocen estudios sobre el posible efecto de la toxina vacuolozante
VacA, que dependiendo de su concentración en los micronichos
de infección, es capaz de mediar el fenómeno apoptótico
de las células del epitelio gástrico con infección,
que puede favorecerse por dos factores conocidos: la duración
por años de la infección y posibles concentraciones
altas de la toxina VacA que aumentarían el proceso apoptótico,
y lo contrario haría que disminuyera dicho efecto ( 57
). En el estudio de los mediadores moleculares de la apoptosis
se ha demostrado un aumento de la expresión del supresor
tumoral p53 y de la proteina pro-apoptótica BaK en respuesta
a la infección por H pylori. La proteina p53 es esencial
para la inducción de apoptosis como respuesta a un daño
cromosómico, actuando por bloqueo de la replicación
del ADN de las células dañadas, y sí las
lesiones del cromosoma no pueden ser reparadas en cierto tiempo,
las células mueren por apoptosis. El gen que que codifica
el p53 esta inactivado en un 50 % de las neoplasmas humanas incluyendo
las gástricas, permitiendo a las células neoplásicas
sobrevir y reproducirse aún en presencia de su ADN dañado,
favoreciendo futuras mutaciones ( 57, 58 ).
La respuesta humoral desde que se establece la infección
por el H pylori, se producen inmunoglobulinas diversas, y que
actúan activando mecanismos efectores; así la IgA
es la inmunoglobulina principal de las mucosas, actuando como
la primera línea de defensa ante diversos agentes patógenos,
desempeñando un papel importante al facilitar la fagocitosis,
siendo de gran utilidad en el diagnóstico no invasivo de
infección detectándola en muestras de saliva en
niños. La IgG activa la clásica vía del complemento
C, que favorece opsonización y también la fogocitosis,
y es la inmunoglobulina empleada en el diagnóstico y en
el seguimiento. La IgM se presenta en los pacientes que cursan
con primoinfección de H pylori, lo cual es poco frecuente
en los países en desarrollo por la habitual infección
desde temprana edad y a la falta de investigaciones. La IgE y
que representa la mediadora de los procesos de hipersensibilidad
de tipo 1 en relación a los a reacciones alérgicas,
y que ha tomado importancia al conocerse que el H pylori se asocia
a enfermedades extragástricas, las que se iniciaron con
aceptar que la infección cursa con procesos alérgicos
como la urticaria crónica idiópática; sin
embargo se ha aceptado que los niveles de IgE específica
anti-H pylori, no se asocian proporcionalmente a la severidad
de las patologías y a la respuesta de erradicación
( 59 ).
9.- CUADROS CLÍNICOS
Como se mencionó, de la mayoría de las personas
infectadas en todo el mundo por el H pylori, la proporción
de personas que desarrollan cuadros clínicos con sintomatolgía
y complicaciones representa sólo del 10 al 20 % ( 9, 10
); además de que la sintomatología inicial es muy
inespecífica, difícil de investigar para determinar
los momentos de inicio de la infección, sobre todo, por
que para la mayoría la situación pasa desapercibida,
y en la mayoría de la población mundial, la infección
cursa por años asintomática ( 17 ). Las manifestaciones
clínicas son las digestivas: gastritis, úlcera péptica,
dispepsia no ulcerosa, adenocarcinoma, el linfoma gástrico
tipo MALT y las manifestaciones extragástricas ( 60 ).
9.1.- GATRITIS
La gastritis que se origina después de la infección
por H pylori, puede evolucionar sin sintomatología, o bien
manifestar la expresión clínica propia de las gastritis
aguda: dolor en epigastrio, nauseas, vómitos, anorexia,
malestar general y en algunos casos fiebre, sintomatología
que se prolonga por una semana, para desaparecer habitualmente
sin tratamiento, es decir en la primoinfección el cuadro
es autolimitado. La infección permanecerá indefinidamente
con o sin sintomatología, evolucionando a la forma crónica,
ocasionando: gastritis crónica superficial difusa, que
puede evolucionar a gastritis atrófica en parches o multifocal,
a una verdadera atrofia gástrica y a metaplasia gástrica
( 59, 60 ).
9.2.- ÚLCERAS PÉPTICAS
Actualmente se conoce que más del 90 % de los pacientes
con úlcera duodenal y de 50 % a 80 % de los pacientes con
úlcera gástrica están infectados con el H
pylori ( 60 ); pero lo que siempre ha sido un enigma es el de
que sólo el 10 % de todos los infectados, pueden desarrollar
úlceras pépticos por lo que se acepta, el que deban
existir otros factores etiopatogénicos necesarios para
que se presente la complicación ulcerosa, centrándose
las investigaciones en la infección por cepas bacterianas
más virulentas, la susceptibilidad o la resistencia del
hospedero a la infección, una susceptibilidad genética
y por supuesto factores ambientales. La edad en que se adquiere
la primoinfección por H pylori, puede influir en la posibilidad
de que se desarrollen úlceras pépticas duodenales
y gástricas; si la infección se adquiere en edades
tempranas existen más posibilidades de desarrollar gastritis
crónica atrófica, con una disminución de
la secreción ácida gástrica, lo que favorece
la formación de úlceras gástricas y menor
posibilidad de desarrollar úlceras duodenales; y si la
infección se adquiere en edades tardías en donde
la gastritis afectará predominantemente el antro gástrico,
la secreción ácida estará aumentada, lo que
favorece la formación de úlceras duodenales ( 61
). Se conoce por años que los individuos portadores del
grupo sanguíneo 0, tienen una frecuencia de úlcera
duodenal de 30 % a 40 % más elevada que los individuos
con grupos A, B o AB, pero no se ha demostrado o encontrado diferencias
en las prevalencias de infección, ni en la magnitud de
la infección inducidas por H pylori, en relación
a los diferentes grupos sanguíneos o del factor de Rh (
36 ). Al parecer y como ya se mencionó, el potencial ulcerogénico
de las diferentes cepas de H pylori depende de la producción
de la proteina CagA, asociada a toxicidad y que representa el
efecto lesivo característico del H pylori sobre las células
epiteliales, aumentando la permeabilidad de las membranas a la
acción de la citotoxina vacuolizante VacA también
secretada por la bacteria. Así las cepas CagA +, se han
asociado a una mayor densidad bacteriana en la mucosa gástrica,
mayor inducción en la producción de interleucinas
y producir más inflamación que las cepas CagA -
. El grado y la distribución de la gastritis ocasionadas
por el H pylori será un factor determinante en las alteraciones
de la secreción ácida y contribuir a la patogenia
de la ulcerogénesis ( 61 ).
Un hecho importante es el ya mencionado de que la prevalencia
de infección para la úlcera duodenal es de 95 %
o más en diferentes zonas del mundo, excepto en algunos
países desarrollados como los EEUU en donde se reportan
cifras menores ( 10 % a 60% ), lo que se relaciona a que también
la prevalencia de infección para toda su población
también es menor, demostrándose que la tasa de prevalencia
de úlcera duodenal, atribuible a infección por H
pylori, disminuye cuanto es menor la prevalencia de la infección
por H pylori en la población general. Esto es lo que ha
sucedido en los países desarrollados en donde el problema
de la úlcera duodenal ha disminuido, ya sea por efectos
de terapias de erradicación o por sus mejores condiciones
socioeconómicas y de salud ambiental ( 8 ). En síntesis
entre los factores de virulencia y patogenicidad del H pylori,
que contribuyen directamente a las alteraciones de la barrera
mucosa, a la lesión del epitelio y a la ulcerogénesis,
destacan: las toxinas, los mediadores de la inflamación
y la secreción ácida gástrica ( 38 , 62 buscar
ref de disminución de up).
9.3.- DISPEPSIA NO ULCEROSA
La dispepsia no ulcerosa es una entidad clínica que forma
parte de los cuadros de los trastornos funcionales del aparato
digestivo, y cuyo diagnóstico implica necesariamente una
ausencia de alteraciones anatomopatológicas con métodos
de ayuda diagnósticos convencionales. La dispepsia no ulcerosa
es muy frecuente y se caracteriza por sintomatología digestiva
alta muy heterogenea, que incluye molestia o dolor franco en epigastrio,
sensación de plenitud postrprandial, saciedad digestiva
con poco alimento, eructos, nausea, pirosis o simplemente lo espresada
como mala digestión. El síndrome de dispepsia no
ulcerosa es diagnóstico de exclusión, y sobre todo
con la endoscopia, que reporta mucosa gastroduodenal normal. Ante
esta contundencia , se han atribuido como factores causales o
etipatogénicos, a trastornos motores gástricos,
alteraciones emocionales e incluso prsiquiátricas, inflamación
microscópica de la mucosa y a la presencia de colonización
por H pylori; esto se ha demostrado por la identificación
de la bacteria en biopsias de antro por prueba rápida de
ureasa y lo significativo con reportes endoscópicos de
normalidad macroscópica y en pacientes con dispepsia no
ulcerosa, y que por sintomatología incapacitante se llegó
a la endoscopia ( 63 ). Los reportes en pediatría han sido
más frecuentes que en adultos, pero en la mayoría
de estos, e incluso en trabajos de revisión publicados
en el año 2007, se demuestra la asociación de H
pylori y dispepsia no ulcerosa y con endoscopias normales, con
frecuencias que van de 60 % a 90 % de los grupos estudiados, con
el hecho a valorar de corresponder a países en desarrollo,
que como se conoce tienen altas prevalencias de infección
por H pylori. Al reconocerse las dificultades que siempre se han
tenido, en el manejo de los pacientes con síndrome de dispepsia
no ulcerosa y no identificarse patologías, rapidamente
se trató de implicar al H pylori como otro causante de
los síndromes de dispepsia no ulcerosa, pero el problema
surgió cuando existiendo reportes que muestran mejoría
de la sintomatología con los tratamientos de erradicación
( 64 ), también aparecieron reportes que reportan que no
hay mejoría ( 63 ). Las controversias persisten cuando
se trata de valorar los costos y los beneficios de tratamientos
de erradicación, en pacientes con síndrome de dispepsia
no ulcerosa, pero que pertenecen a países de muy alta prevalencia
y sobre todo en los estratos socioeconómicos bajos ( 65
). Pero en general se recomienda que todo paciente con síndrome
dispepsia no ulcerosa de más de tres meses de evolución,
y de la tercera edad en adelante, deberán ser sometidos
a endoscopia, y aún cuando el endoscopista reporte especto
macroscópico normal de la mucosa gástrica, se deberán
tomar biopasias de antro, cuerpo, incisura angulares y del fondo
gástricos, para investigar H pylori, efectuando prueba
rápida de ureasa y estudios histopatológicos ( 66,
67 ).
9.4.- INFECCIÓN POR HELICOBACTER Pylori Y EL USO
DE ANTIINFLAMATORIOS NO ESTEROIDEOS
La frecuencia de asociación en úlcera péptica
con la ingesta de antiinflamatorios no esteroideos ( AINE´s
) y la infección por H pylori, se reporta en cifras hasta
del 50 %, pero se desconoce si la presencia de la infección,
aumenta el riesgo de desarrollar úlcera péptica,
y sobre todo complicaciones, y de estas la que más ha preocupado
es la hemorragia, en los pacientes tratados con dichos fármacos.
Existen evidencias de que el H pylori en dichas circunstancias,
parecería ser un espectador inocente, de que su presencia,
puede ser la consecuencia y coincidencia de las altas prevalencias
ya mencionadas para la población general, prevalencia que
aumenta con la edad, y es precisamente en pacientes adultos mayores
en donde más se utilizan los antinflamatorios no esteriodeos
y la aspirina a dosis convencionales, o menores como antitrombótico
. Incluso existen referencias que al H pylori, le han atribuido
la posibilidad de ser un factor de protección, al disminuir
la secreción ácida por afectación de las
células parietales y principales del cuerpo y fondo gástrico.
El papel de la bacteria en la etiopatogenia de la úlcera
péptica está fuera de duda, lo que es controvertible
es el papel que pueda tener per se como factor patogénico
determinante, en la evolución de la enfermedad ulcerosa
péptica a sus complicaciones: la perforación y la
hemorragia. Lo que si existe y demostrado, es que otros actores,
si influyen como factores de complicación y son definitivos:
la edad y la ingesta de AINE´s; y en menos grado: el tabaquismo,
alcoholismo, la medicación con esteriodes y los anticoagulantes.
Esto no invalida el beneficio que se pueda tener, al administrar
un tratamiento de erradicación para el H pylori en el tratamiento
de la úlcera, para evitar las recurrencias, pero no es
garantía de protección en pacientes de la tercera
edad, que son tratados en forma permanente con AINE´s, aspirina
y esteroides, es decir que las complicaciones siguen teniendo
una relación directa con dichos fármacos ( 68, 69,
70 ).
9.5.- ADENOCARCINOMA
El papel de la infección crónica por H pylori en
la producción de adenocarcinoma gástrico, ( por
costumbre se denomina carcinoma ) tiene por antecedente a la gastritis
crónica secundaria a la infección por la bacteria,
lo que se ha demostrado en países con alta prevalencia
de adenocarcinoma gástrico, y con una alta prevalencia
de infección por H pylori; se conoce también que
en las regiones con alta prevalencia de adenocarcinoma gástrico,
la infección se adquiere desde la infancia, situación
que se ha demostrado en México, por estudios realizados
en el estado de Chiapas ( 71 ). Los estudios epidemiológicos
transversales que han valorado la coexistencia de infección
con adenocarcinoma gástrico a partir de biopsias de mucosa
gástrica, obtenidas en el momento del diagnóstico
de las neoplasias, muestran una cifra significativamente mayor
en relación a controles sin neoplasias. Cuando la prevalencia
de la infección se ha investigado por estudios de anticuerpos
serológicos en lugar de la histología, la prevalencia
es aún más significativa; la explicación
que se informa en relación a las diferencias entre los
estudios histológicos y a favor de los serológicos,
es de que la mayoría de los pacientes llegan a la gastritis
crónica atrófica, con focos de metaplasia intestinal,
lo que implica una disminución de la identificación
de la bacteria en las biopsias ( 36 ). Los estudios más
concluyentes son los prospectivos, que investigan la serología
en pacientes sanos antes de que desarrollen adenocarcinoma gástrico,
con seguimiento hasta de 25 años, que demuestran que la
prevalencia de la infección por H pylori, es sin duda muy
superior a las cifras obtenidas de controles, hecho que se hace
más evidente según se alargue a 15 años o
más el seguimiento ( 36 ). No obstante que estos estudios
epidemiológicos transversales y prospectivos parecen demostrar
una relación causal, que puede ser circunstancial y no
definitiva, la Organización Mundial de la Salud ( OMS )
desde 1994, clasificó al H pylori como agente carcinógeno
en la categoría I ( 72 ). Así, la infección
por H pylori se convirtió en un modelo de estudio de desarrollo
de cancer, como consecuencia de una infección crónica,
siendo el responsable del 5.5 % de los 1.9 millones de tumores
malignos ocasionados por agentes carcinógenos infecciosos
( 73 ). Actualmente se acepta que la infección por H pylori
representa un riesgo 6 a 8 veces mayor para el desarrollo de tumores
gástricos, más para el adenocarcinoma de tipo intestinal
que con el difuso, lo que se ha demostrado por la prevalencia
de H pylori en 80 % o más en los adenocarcinomas de tipo
intestinal, y de sólo 30 % para los de tipo difuso ( 36,
48, 74 ); la prevalencia de la infección también
se ha demostrado diferente en función de la localización
de la neoplasia en el estómago, en donde la localización
en el cardias sin duda no se relaciona a la infección,
como si lo es para las localizaciones en cuerpo y sobre todo en
el antro ( 74 ). Sin duda sólo una minoría de los
pacientes infectados desarrollarán adenocarcinoma gástrico,
y para los que lo hacen, se debe a la capacidad que tiene la bacteria
para ocasionar gastritis crónica y metaplasia intestinal,
que se consideran lesiones precursoras, a las que se pueden agregar
otros factores que predisponen, como la edad, el reflujo biliar,
hereditarios y sobre todo el que las cepas infectantes expresen
el gen cagA ( 21 ). Las bacterias más patógenas
se caracteizan por tener un racimo de genes que integran la ya
mencionada isla de patogenicidad, que codifica la proteína
CagA, que es responsable de su traslocación a las células
epiteliales gástricas del hospedero; la proteína
ya dentro de la célula, induce la producción de
citocinas proinflamatorias: interleucina-1beta ( IL-1b ) y sus
receptores antagonistas , la interleucina-8 ( IL-8 ), la interleucina-10
( IL-10 ), el factor de necrosis tumoral alfa ( FNTa ) y otras
citocinas, que activan y reclutan células inflamatorias
en la mucosa, ocasionando gastritis severa y alteraciones en la
secreción del ácido; el poliformismo específico
de la interleucina-1beta ( IL-1b ) por agrupación de genes,
incrementa el riesgo de adenocarcinoma gástrico. Se supone
que a la inflamación gástrica con severo daño
epitelial y repetidos procesos de reparación, pueden condicionar
errores en los procesos de mitosis de las células epiteliales,
con proliferación de células que muestren alteraciones
cromosomales, que finalmente llevan al adenocarcinoma. Se han
mencionado otras alternativas para explicar la relación
causa efecto de la presencia del H pylori y el adenocarcinoma
gástrico, teniendo en cuenta que no todos los infectados
y aun con cepas CagA + desarrollarán neoplasias. Una de
ellas menciona como factor, y que influye en la carcinogénesis
en relación a la infección crónica por H
pylori, es la disminución del índice de apoptosis,
con un incremento de la proliferación celular en los pacientes
infectados por cepas CagA +, respecto a los pacientes CagA - o
los pacientes no infectados ( 21, 74 ). Otra alternativa es la
de reconocer que el medio de la mucosa infectada e inflamada por
el H pylori, promueve mensajeros para que se injerten en ella
células pluripotenciales de la médula ósea,
células que ante un ambiente inhóspito y extraño,
inicien alteraciones en su crecimiento y diferenciación,
que lleven al desarrollo de cancer. ( 75, 76 ). La carcinogénesis
también puede relacionarse a otros mecanismos: toxinas
bacterianas y proteinas dañinas secretadas por el H pylori
o por el propio hospedero, en respuesta inmunológica desencadenada
por la infección, como la expresión de proto-oncógenes,
el incremento de las concentraciones de las lipasas y de proteasas
derivadas del metabolismo bacteriano, la disminución de
la secreción del ácido ascórbico, que como
potente antioxidante es capaz de eliminar radicales libres de
oxígeno y nitritos, así como el de impedir la formación
de nitrosaminas, y que son los que más se mencionan en
la literatura ( 21 ). En conclusión, el clásico
modelo aceptado desde la década de los años 70s,
con una concepción lógica y sencilla para el desarrollo
del adenocarcinoma gástrico: mucosa normal, gastritis crónica,
gastritis atrófica, metaplasia, displasia y cáncer,
ya no es suficiente, que la temporalidad prolongada de los procesos
de carcinogénesis también tienen etapas, que son
multifactoriales, y que como en el caso del adenocarcinoma gástrico
participan: el momento de la infección por H pylori, la
genética de la bacteria ( cepas CagA + ), las dietas, la
genética y la herencia del hospedero ( 72, 75 ).
9.6.- LINFOMA MALT
Se reconoce la asociación de infección por H pylori
con el linfoma gástrico asociado a mucosas ( MALT por sus
siglas en ingles ), representando el 10 % de todos los linfomas,
y el 3 % de todas las neoplasias gástricas ( 76, 77, 78
). Estos tipos de linfomas gástricos son consecuencia de
un estímulo autoinmune antigénico crónico,
como es el caso del H pylori, y se originan de linfocitos B y
son calificados como de bajo y alto grado, de acuerdo a su extensión
y morfología, localizándose casi siempre en la región
del antro. Wotherspoon en 1991 publicó por primera vez
en la revista Lancet la asociación entre la infección
por H pylori, y la respuesta inflamatoria de linfocitos B, en
la forma clásica de gastritis folicular y las neoplásias
MALT ( 79 ). A diferencia en relación a los adenocarcinomas
gástricos, para fines del siglo XX la evidencia epidemiológica
que apoyara a la asociación de linfomas e infección
por H pylori, era sin duda menor, y las evidencias de esta asociación
entre H pylori y neoplasias MALT, se iniciaron con los resultados
de publicaciones, que documentaron la remisión o regresión
total de los linfomas de bajo grado, ya que para los linfomas
de alto grado y aún asociados a la infección, se
ha requerido siempre tratamiento oncológico, además
del de erradicación de la bacteria, y desde el diagnóstico
inicial. A la fecha sin duda, se acepta, que las personas infectadas
con H pylori, tienen seis veces más de posibilidades de
adquirir un linfoma asociado a mucosas, en relación a las
personas no expuestas a la infección, como se publicó
desde 1994 en el trabajo clásico de Parsonnet ( 80 ). Además
existe el hecho de que las incidencias de linfomas gástricos
de bajo y de alto grado, son superiores en poblaciones con alta
prevalencia de infección por H pylori, y de que la identificación
de la bacteria se obtiene hasta en el 90 % de los pacientes con
linfoma MALT de bajo grado ( 81 ). El crecimiento neoplásico
de este tipo de linfomas, se relaciona al estímulo antigénico
por parte del H pylori sobre los linfocitos T, células
que producen citocinas como las IL-2 e IL-8, reponsables de la
estimulación de los linfocitos B localizados en el borde
externo de los folículos linfoides, induciendo degeneración
maligna en células centrocitoides marginales monoclonales,
que infiltran y destruyen el epitelio gástrico, dando lugar
a las lesiones linfoepiteliales características de este
tipo de linfomas. La afectación histológica de la
gastritis crónica asociada a infección por H pylori,
se evidencia por proliferación linfoide o hiperplasia linfoide
focal, lo que explica en ocasiones las dificultades para diferenciarla
del linfoma MALT. Si el estímulo antigénico sigue
evidenciándose, el linfoma MALT de bajo grado, evoluciona
a linfoma MALT de alto grado, lo que se caracteriza por la presencia
de células gigantes: centroblastos e inmunoblastos ( 81
). La regresión de los linfomas MALT después del
tratamiento habitualmente es lenta, reportándose tasas
de remisión del 60 % a 70 % de los de de bajo grado, y
en general las remisiones son estables al año de seguimiento
a los tratamientos de erradicación; los linfomas MALT que
afectan sólo la mucosa y a la submucosa responden mejor
al tratamiento, y que la presencia de un patrón infiltrante
difuso y la localización proximal del cuerpo gástrico,
son factores de pronóstico negativo. Después de
la remisión completa de un linfoma MALT, en la mitad de
los pacientes, la monoclonicidad desaparece, indicando remisión
molecular y remisión completa, pero en la otra mitad persiste
el estado monoclonal, que encubre altos riesgos de recidiva del
linfoma, por lo que todos los pacientes, ameritan control estricto
( 36, 81 ). Existe la tendencia a sustituir la denominación
de linfoma asociado a mucosas ( MALT ) por el de linfoma gásrico
tipo B de la zona marginal o maltoma ( 82 ).
10.- INFECCIÓN CRÓNICA POR HELICOBACTER
pylori Y ENFERMEDADES EXTRADIGESTIVAS
El H pylori ha vivido en la mucosa gástrica humana por
miles de años, por su capacidad de neutralizar el ácido
gástrico, de propiciar una respuesta inmune local y sistémica
del hospedero ,cuya capacidad de eliminarlo, se ha mostrado limitada,
propiciando una infección persistente, y ser causa de enfermedades
gástricas, pero también se empezaron a describir
o identificar otras enfermedades extradigestivas en pacientes
infectados, es decir patologías distantes al sitio primario
de infección, con probable relación a alteraciones
inflamatorias sistémicas, iniciándose investigaciones
para conocer si dichas enfermedades eran realmente relevantes.
Las que más se mencionan son las enlistadas ( 18, 21 ).
SÍNDROMES ANÉMICOS.- Anemia ferropénica
idiopática, habiéndose demostrado niveles bajos
de ferritina sérica con títulos elevados de anticuerpos
anti-H pylori, además de que el tratamiento de erradicación
y aun sin tratamiento complementario con hierro, mejora el síndrome
anémico. En esta enfermedad extradigestiva, si se ha demostrado
una relación entre la infección por H pylori y la
presencia de anemia ferropriva, respaldada por trabajos que permiten
obtener niuvel de evidencia 1, de acuerdo con el III Concenso
de Maastricht sobre H pylori del 2006 ( 83 ). Los demás
padecimientos que se han ido acumulando a la lista de asociación
con la bacteria entran a los niveles de evidencia 4 ( serie de
casos ) y 5 ( opiniones de expertos ), con grados de recomendación
C y D.
ENFERMEDADES AUTOINMUNES.- Tiroiditis autoinmune, artritis reumatoide,
púrpura trombocitopénica autoinmnune, síndrome
de Sjögren ( 14 ).
ENFERMEDADES DERMATOLÓGICAS.- Urticara crónica,
rosacea, alopecia areata, dermatitis atópica, púrpura
de Henoch-Schöenlein ( 16 ).
ENFERMEDADES CARDIOVASCULARES.- Isquemia coronaria, accidentes
cerebro-vasculares, migraña, fenómeno de Raynaud.
La infección por H pylori se ha reportado asociado a un
mayor riesgo de padecer enfermedades cardiovasculares, asociación
que es independiente a otros factores de riesgo ( tabaquismo,
hipertensión arterial, hiperlipidemias ), y una de las
hipótesis que más se mencionan es la de que se presentan
modificaciones al metabolismo lípídico con aumento
de triglicéridos y una reducción del Hdl-colesterol;
la inflamación persistente de la mucosa gástrica
por la infección crónica por H pylori incrementa
la concentración de proteinas como el fibrinógeno
y ácido siálico que son predictores de enfermedad
coronaria; se han reportado niveles elevados de homocisteina en
pacientes infectados, relacionados a un incremento de riesgo de
arterioesclerosis prematura, lo que se debe a que dicha proteina
inhibe la secreción de óxido nítrico por
las células endoteliales, que facilita la agregación
plaquetaria y la vasoconstricción, además de que
altera el balance entre los favorecedores e inhibidores de la
coagulación sanguínea. La elevación de la
hemocisteina en la sangre se relaciona a deficiencias de vitamina
B6, B12 y de ácido fólico, que son necesarios para
los diferentes pasos de remetilación y transulfuración
de la hemocisteina; esto es importante por que los pacientes infectados
con H pylori, tienen absorción deficiente de ácido
fólico y de cobalamina, lo que es causa de cuadros de polineuropatías,
sobre todo si se asocia infestación con GIARDIA lamblia,
la que predispone a la acumulación de hemocisteina ( 9,
15, 16, 17 ).
OTRAS ENFERMEDADES.- Se mencionan también otras enfermedades
como la diabetes mellitus, tiroiditis, glaucoma crónico
de ángulo abierto, encefalopatía amoniacal y obesidad,
para las cuales la información sobre el papel que pueda
tener la infección crónica por H pylori, está
tomando interés creciente ( 15, 16 ).
11.- EFECTOS DEL H pylori SOBRE LAS HORMONAS LEPTINA
Y GHRELINA
Últimamente se ha mencionado hechos de observación
de que la colonización por H pylori, ha afectado la expresión
de las hormonas que controlan el apetito y la saciedad; se conoce
que la leptina es secretado por el tejido adiposo y en el estómago
por las células principales y las células parietales,
liberada en respuesta a los alimentos y estímulos hormonales
asociados; la leptina señala la sensación de saciedad
al hipotálamo, ocasionando una inmediata reducción
de la ingesta de alimento, aumenta la utilización de energía,
reduce la secreción de gastrina y del ácido gástrico
y aumenta la proliferación de células de la mucosa
gástrica. La ghrelina se produce en las glándulas
oxínticas y se libera durante el ayuno y su producción
es bloqueada por la leptina y la ingesta de alimentos. Azuma en
el 2001 ( 84 ), reporta que los niveles de leptina gástrica
son más elevados en los individuos colonizados por H pylori
en comparación con los no colonizados, y que el tratamiento
de erradicación de la bacteria disminuye los niveles a
cifras normales; teniéndose la evidencia opuesta de que
los niveles de ghrelina son mas altos en individuos sin infección
bacteriana, y que además dichos niveles se aumentan más
en los individuos que se someten a tratamiento de erradicación.
Es un hecho conocido que se gana peso después de los tratamientos
de erradicación, lo que seguramente tiene una franca relación
hormonal; también se conoce que la obesidad como problema
de salud se ha incrementado notablemente en los países
desarrollados, situación que va aparejada a la demostrada
disminución de las prevalencias de la infección
por H ppylori; es un hecho de que en los países en desarrollo,
la mayoría de los infantes adquieren la infección
antes de los 5 años y que a los 10 años casi el
100 % están infectados, en cambio en los países
desarrollados pocos infantes están infectados. Parecería
que los genes del H pylori representan una contribución
para complementar el papel de los genes humanos para el ahorro
vigoroso de calorías, y que cuando el H pylori desaparece,
la ausencia puede tener un papel importante en la magnitud de
la adiposidad de infantes y de adultos; esta situación
no ha sido suficientemente investigada ( 85, 86 ).
12.- INFECCIÓN PEDIÁTRICA
Hasta antes de que se conociera la importancia de la infección
por H pylori desde la infancia, se aceptaba que la causa más
común del conocido cuadro de dolor abdominal recurrente
en pediatría ( DAR ) era de origen situacional por el entorno
y por tanto psicológico; pero a partir de que se conoció
que el dolor abdominal recurrente en adultos podría relacionarse
a gastritis por H pylori en algunos, ( ya que en otros puede haber
gastritis sin sintomatología ) también se demostró
en estudios realizados por pediatras, y en nuestro medio en el
clásico trabajo de Ramírez Mayans de 1993, se conoce
que el dolor abdominal recurrente en niños, tiene en el
50% de los casos como causa a una gastritis, y de estas, más
del 60% se asocian a infección por H pylori ( 87 ). Por
supuesto que en los niños también el cuadro clínico
se caracteriza por ser inespecífico, siendo el dolor abdominal
recurrente de tipo visceral, localizado al abdomen superior, que
se presenta con tendencia a un ritmo postprandial tardió,
es decir cuando el estómago está vacío, iniciándose
desde las primeras horas de la mañana, dolor que se exacerba
con la ingesta de alimentos, acompañándose de anorexia
o rechazo al alimento y de sensación de plenitud; cuando
el dolor es intenso se presenta interrupciones del sueño
de los niños, además de agregarse náuseas,
vómitos, hematemesis y melenas, y menos frecuente pirosis.
En los niños la infección por H pylori sintomática
se puede asociar con gastritis antral y la úlcera péptica
duodenal relacionada con la bacteria, rara vez se se presenta
en niños menores de diez años ( 25 ). Se ha asociado
a la infección por H pylori en niños, cuadros de
diarreas persistentes, que condicionan desnutrición y retardo
en el desarrollo; también se ha asociado anemias por deficiencias
de hierro, alergia alimentaria, púrpura trobocitopénica,
poliarteritis reactiva con dermografismo y síndrome de
muerte súbita del lactante ( 88 ). El diagnóstico
diferencial en casos de dolor abdominal recurrente en pediatría,
debe hacerse con otras etiologías, como duodenitis por
Giardia lamblia, parasitosis, gastritis por medicamentos y por
supuesto con el síndrome de reflujo gastroesofágico.
Actualmente se acepta que en todo niño que manifieste epigastralgia
y diarrea persistente de etiología no establecida, tanto
el pediatra como el médico general deberán pensar
en infección por H pylori.
13.- DIAGNÓSTICO DE LA INFECCIÓN POR HELICOBACTER
pylori
De acuerdo a lo ya expresado, a que son múltiples los factores
de patogenicidad de la bacteria, y de las respuestas inmunes del
hospedero, que determinan el estado de portador asintomático
o de enfermo, la metodología de los estudios a seguir,
deberá tener por objetivos, el de lograr un diagnóstico
adecuado, ofrecer el mejor y adecuado tratamiento y sólo
en los casos que efectivamente lo ameriten. A medida que se avanzó
y con rapidez en los conocimientos sobre el comportamiento biológico,
la forma de lograr un habitat adecuado para la sobrevivencia,
la permanencia y defensa de la bacteria ante la respuesta inmune,
también rapidamente se desarrollaron diferentes pruebas,
y que son de gran utilidad para establecer con alto grado de confiabilidad
y de certeza la presencia del H pylori. Las pruebas diagnósticas
se han basado en considerar hechos fundamentales derivados de
haber conocido mejor a la bacteria como son: única bacteria
que coloniza el estómago por su capacidad de producir ureasa,
de que se localiza de preferencia y mayor densidad de población
del bacilo en el antro y mucho menos en el cuerpo y fondo gástricos,
que se ha mostrado al H pylori en la placa dental y en las heces,
de que se identifica en pacientes asintomáticos, en la
mayoría con gastritis crónica y úlcera péptica
duodenal, menos en la úlcera gástrica, adenocarcinoma
y tumor MALT, y todavía para el año 2007, su relación
con los rastornos funcionales del aparato digestivo, principalmente
la llamada dispepsia no ulcerosa, no se ha aclarado y es motivo
de controverisias ( 89 ).
Con estos antecedentes, se han reportado múltiples estudios
que comparan los principios y las indicaciones de las varias pruebas
de diagnóstico con que se cuentan en la actualidad, para
el ejercicio de la medicina al respecto, y el eje del diagnóstico
fue tomado por la endoscopia, a partir de la cual, los métodos
que derivan de su aplicación se calificaron de invasivos
y no invasivos a los que no dependen de ella.
13.1.- PRUEBAS INVASIVAS
La endoscopia, prueba rápida de ureasa, biopsias de mucosa
gástrica para estudios histológicos convencionales
o muy complejos ( inmuno-histoquímica, técnicas
moleculares ) y cultivo de biopsias, que se toman de preferencia
del antro gástrico y citología por cepillado. Estos
métodos tienen la indicación precisa en pacientes
con enfermedad ácido-péptica con fuerte base clínica
y ante casos que implica la necesidad de una endoscopia, como
ante la presencia de sintomatología de alarma que obligue
a pensar en proceso neoplásico. Es decir que los métodos
invasivos, no tienen lugar en estudios de prevalencia que incluyen
a individuos asintomáticos.
ENDOSCOPIA.- Sin duda, desde la aparición de los endoscopios
de fibra óptica y de gran flexibilidad, el diagnóstico
de las gastritis, se basó en las observaciones macroscópicas,
en los acuerdos para establecer clasificaciones y dar uniformidad
a los reportes, con las ventajas de tomar biopsias para identificar
a la bacteria, efectuar interpretaciones histopatológicas,
seguidas de también de clasificaciones y de tratar de establecer
correlaciones clínicas. Gracias a dichos recursos, y en
pocos años se conocieron las gastritis secundarias a la
infección por H pylori. Los reportes de las interpretaciones
dadas por los endoscopistas, en relación a los aspectos
de las mucosas gástricas en pacientes infectados por H
pylori, y basadas en la comprobación en por lo menos dos
pruebas positivas, casi todos describen a las gastropatías
por la bacteria como: nodular, folicular, eritomatosa, erosiva,
petequial, atrófica, localizada, multifocal, pangastritis,
duodenitis erosiva, duodenitis con metaplasia e incluso mucosa
normal hasta en el 10 % o más de las series ( 90 ) ( Fotos
1 a la 12 ). En relación a las clasificaciones en el tema
de las gastritis, la más utilizada, y desde 1994, es la
de Sydney, dándole importancia a la integración
de los reportes, con la información macroscópica,
topográfica, morfológica y etiológica, para
lograr un diagnóstico clínico integral. Se defineron
tres grandes grupos de gastropatías.
GASTRITIS CRÓNICA NO ATRÓFICA
-
Inflamatoria
-
Multifocal o autoinmune
GASTRITIS CRÓNICA ATRÓFICA
-
Gastritis atrófica asociada a metaplasia
GASTRITIS CRÓNICAS INDETERMINADAS O NO CLASIFICABLES
Cuando procede, se informa la etiología, como en el caso
del H pylori, agregándose los conceptos de leve, moderada
y severa, para conocer la magnitud de la colonización y
distribución de la bacteria ( 91 ). También se agregan
a los informes histopatológicos el grado de actividad en
relación a la inflamación: ausente, leve, moderada
o intensa. ( 92 )
|
|
Foto 1. – Gastropatía varioliforme.
Gastritis crónca por H. pylori
|
Foto 2. – Gastropatía varioliforme.
Gastritis crónica por H. pylori |
|
|
Foto 3.- Gastropatía varioliforme.
Grastritis crónica por H. pylori |
Foto 4.- Imagen de Mucosa con aspecto
de “empedrado”. Gastritis crónica por
H. pylori |
|
|
Foto 5.- Gastritis crónica de
fondo
gástrico por H. pylori |
Foto 6.- Gastritis crónica de
fondo
gástrico por H. pylori |
|
|
Foto 7.- Duodenitis superficial por
H. pylori |
Foto 8.- Duodenitis superficial no erosiva
por H. pylori |
|
|
Foto 9.- Úlcera duodenal y duodenitis
por H. pylori |
Foto 10.- Úlcera gástrica
y gastritis crónica por H. pylori |
|
|
Foto 11.- Linfoma (MALT) de cuerpo gástrico
asociado a H. pylori |
Foto 12.- Linfoma (MALT) de cuerpo gástrico
asociado a H. pylori |
PRUEBA RÁPIDA DE UREASA.- Se basa en el conocimiento que
se tiene de que sí la biopsia tiene H pylori, la ureasa
hidroliza un sustrato comercial de urea, para convertirla en amonio
y en anhídrido carbónico, reacción que es
alcalina, lo que permite modificar el color de un indicador de
pH con rojo fenol agregado, cambiando de color amarillo a bugambilia;
este cambio puede ser rápido ( fast ), que se debe a una
mayor densidad bacteriana, o tardío dentro de 24 hora posteriores
a la toma de la biopsia. Al principo se hacian preparaciones en
los laboratorios de bacteriología y que no era difícil,
pero en la práctica clínica actual todos los endoscopistas,
utilizan soluciones o gelatinas de firmas comerciales y las más
utilizadas son: CLO-test, Cu-test, JATROX-tes y el Pylori-test.
En general su utilidad es similar y se reportan sensibilidades
de 90 % a 95 %, con especificidades de 95 % a 100 %, con el inconveniente
de que aun cuando los sustratos comerciales de urea son accesibles,
es necesario agregar el costo de la endoscopia. En general los
resultados falsos + con la prueba rápida de ureasa son
poco frecuentes, ( se menciona como causas de falsos + la posible
presencia de contaminación de las biopsias por otras bacterias
productoras de ureasa especialmente estreptococos y estafilococos,
sobre todo cuando el sustrato de urea se administraba por vía
oral; e incluso algunas falsos + se atribuyen a otras bacterias
de género HELICOBACTER como el H heilmanni que se ha considerado
como agente causal de gastritis , situación muy rara (
10 ). La sensibilidad de la técnica dependen de la densidad
de las bacterias, considerando un mínimo de 10, 000 bacterias
en la muestra para que el resultado sea positivo; también
pueden presentarse falsos - , si el número de bacterias
en la muestra es muy escaso, por colonización disminuida
a consecuencia de tratamientos previos inmediatos con inhibidores
de la bomba de protones, sales de bismuto, antibióticos
e incluso sucralfato; por supuesto que la sensibilidad aumenta
si se toman más de una biopsia, sobre todo en pacientes
con atrofia y metaplasia gástricas severas, que no tienen
H pylori en las muestras, lo que ocasiona falsos - , y se conocen
como errores de muestra. La sensibilidad de la prueba también
disminuye en forma significativa en al presencia de hemorragia
digestiva y sin antecedentes de tratamiento previo de erradicación,
lo que se atribuye al efecto tampón de la albúmina
sobre el indicador de pH, mas que por un efecto directo sobre
la inhibición de la actividad de ureasa ( 89, 91 ).
CULTIVOS.- El cultivo es el método con máxima
especificidad de 100% para el diagnóstico de infección
por H pylori, lo que le confiere superioridad comparada con las
otras pruebas disponibles, llegándose a considerarla como
el estandar de oro, pero la sensibilidad se reporta con variaciones
importantes que varían de 60 % a 90 %, lo que se debe a
que su realización no es fácil; en la sensibilidad
influyen la densidad bacteriana, las condiciones del transporte
de las muestras, del tiempo que trancurre desde la toma y el procesado,
las condiciones de incubación y los tratamientos previos
con omeprazol, antibióticos, sales de bismuto, sucralfato
e incluso benzocaina. El cultivo tiene la ventaja de que permite
la realización de antibiogramas y estudiar las resistencias
bacterianas a diversos antibióticos, en casos clínicos
específicos o en estudio de poblaciones muy limitadas.
Como en todas las infecciones el cultivo de H pylori, es el método
para el diagnóstico válido, para poder tipificar,
y por ahora es el único método que permite analizar
la sensibilidad a los antibióticos, permite estudiar factores
de virulencia y obtener nuevos antígenos para técnicas
de diagnóstico serológicos. Para conseguir los mejores
resultados con el método, y lograr mejores desarrollos
de la bacteria, en general se recomienda la utilización
de dos medios de cultivo, uno no selectivo suplementado con sangre,
y otro selectivo con diferentes antibióticos que inhiban
la flora bacteriana bucal. Es conocido que la bacteria es muy
sensible a los cambios de temperatura durante su cultivo, a la
necesidad del adecuado medio microaerofílico, de que las
colonias tienen crecimiento lento, con aparición de las
primeras colonias a partir del 5º día e incluso aparecer
hasta el 10º día, siendo indispensable la identificación
de enzimas ureasa, oxidasa y catalasa. El cultivo de las biopsias
gástricas es el más estudiado para aislar H pylori,
pero también es el más caro, por que se necesita
agregar el costo de la endoscopia, por lo que se ha intentado
y logrado el cultivo de la bacteria en muestras de jugo gástrico,
de heces fecales y del material obtenido de hilo dental ( 9, 89
).Sin duda, al aislamiento del H pylori de la placa dental, incluso
en individuos sanos asintomáticos, ha ocupado un papel
clave en la epidemiología de la infección, haciéndolo
responsable de las no raras recidivas postratamiento, y de representar
una posible vía de adquisición de la infección
( 9, 89, 93 ).
HISTOLOGÍA.- La identificación del H pylori en
biopsias, se puede lograr mediante técnicas de microscopía
directa con procesado de las muestras con tinciones de Gram, procedimiento
fácil y rápido con sensibilidades cercanas al 90
% y especificidades también cercanas al 100%, sobre todo
si se logra el estudio de biopsias múltiples y simultaneas
del antro y del cuerpo gástrico. También se ha utilizado
la tinción con azul de metileno, que es más sencilla,
que obtiene los mismos resultados que con la tinción de
Gram y sin embargo en nuestro medio no ha tenido la aceptación
de otros países ( 94 ). La histología con técnicas
llamadas convencionales ha permitido el diagnóstico de
infección, es decir la identificación de la bacteria,
pero además proporciona valiosa información sobre
las alteraciones de la mucosa gástrica, evaluar la densidad
bacteriana en el epitelio gástrico en forma semicuantitativa,
la magnitud y características de la gastritis, la actividad
inflamatoria aguda y crónica, la atrofia de la mucosa,
la metaplasia intestinal y la presencia de folículos linfoides;
estas ventajas se amplían cuando un endoscopista experimentado
tiene la precaución de tomar biopsias numerosas de antro,
incisura angulares, cuerpo y fondo, teniendo el cuidado de que
el antro sea el mas muestreado, por el conocimiento que se tiene,
de que es la zona habitual de máxima colonización
por el H pylori. Con histopatólogos experimentados sus
sensibilidades alcanzan hasta 96 % y especificidades de casi 100
% ( 36, 92 ).
Las biopsias deben ser conservadas en formaldehído al
10 % amortiguaado antes de su procesamiento, y la elección
del método de tinción casi siempre se debe a la
experiencia y preferencias de los histopatólogos. Las más
utilizadas son la tinción convencional de hematoxilina
y eosina y tinciones especiales como la de Giemsa y la de Genta,
muy similar a la de Warthin-Starry, que permiten una rápida
identificación de la bacteria; con todas se reportan resultados
convincentes, sin diferencias importantes, salvo los costos que
son mayores para las tinciones especiales. Los resultados falsos
- por histología son raros y habitualmente obedecen a errores
de muestreo, ya que la colonización bacteriana es por parches
o focal, y las biopsias pueden tomarse en areas de metaplasia
intestinal y de atrofia gástrica; también por la
presencia escasa de bacterias debida a medicación previa
antes de la endoscopia. Aquí también el costo de
la endoscopia que se agrega, hace que el método actualmente
pierda competitividad con otros métodos no invasivos.
Se han logrado técnicas de inmunohistoquímica e
inmunofluorescencia, utilizando anticuerpos monoclonales y policlonales
frente al H pylori, aplicados directamente en el material fresco
de las biopsias, en cortes por congelación y en muestras
fijadas en formaldehído, habiéndose informado alta
especificidad y lo más importante muy pocas diferencias
entre los histopatólogos. Por ser procedimientos de alta
complejidad y realizados por expertos en inmunohistoquímica,
su disposición es limitada, los costos se elevan notablemente,
de ahí que su utilidad se limita a protocolos de investigación
y no a la clínica diaria ( 89 ).
La infección por H pylori puede cursar sin manifestaciones
clínicas y en los sintomáticos, el diagnóstico
se sustenta en un buen número de pacientes con la endoscopía,
la prueba de ureasa rápida y la identificación de
la bacteria en las biopsias, pero también se incluye el
conocer la apariencia macroscópica de la mucosa gástrica,
que pude estar alterada en forma evidente, mínima o normal;
es decir que unas biopsias se destinan a estudios histopatológicos
convencionales o especializados, para conocer la magnitud y las
características del daño que el H pylori produce
en forma directa e indirecta de la mucosa gástrica ( Fotos
13, 14, 15 ).
CAMBIOS SUGESTIVOS DE INFECCIÓN AGUDA POR H pylori.- Pérdida
de la secreción apical de moco, apoptosis en el epitelio
de la críptica, erosión de la mucosa, ulceración,
infiltraciones celulares principalmente neutrófilos ( actividad
) y se hace diagnóstico morfológico de GASTRITIS
AGUDA.
Al daño sigue una reparación inmediata que se inicia
en el cuello de las glándulas, en forma de regeneración
epitelial que se identifica fácilmente en los cortes y
tinciones convencionales, y su magnitud se relaciona directamente
al daño, y se conoce que el recambio celular de la mucosa
gástrica infectada es dos veces más que en la no
infectada, proceso que se desencadena por acción del amonio
y de múltiples reactantes químicos producidos durante
el proceso inflamatorio y que son capaces de inducir una respuesta
alterada de la mucosa. La regeneración se establece a través
de células totipotenciales, situadas en el cuello de las
glándulas, que es una zona proliferativa, en donde también
se pueden originar eventualmente células mucosas, parietales
y neuroendócrinas. Si la regeneración se limita
a un tercio de la longitud de la cripta, se le considera regeneración
típica, pero si se extiende a la mitad de la cripta, se
le considera regeneración atípica. Las células
con cambios regenerativos muetran núcleos vesiculosos,
situación descrita en situaciones preneoplásicas
de la mucosa gástrica: metaplasia intestinal, gastritis
crónica atrófica, en mucosa de estómagos
operados con resecciones, en mucosa vecina a úlceras gástricas
y en mucosa cercana a un adenocarcinoma ( 95 ).
CAMBIOS CARACTERÍSTICOS DEL DAÑO CRÓNICO
POR INFECCIÓN POR H pylori.- Cambios regenerativos típicos,
cambios regenerativos atípicos, displasias en grado variable,
metaplasmas, infiltraciones celulares: linfocitos, células
plasmáticas, moncitos, macrófagos, menos neutrófilos
y eosinófilos, haciendo el diagnóstico de GASTRITIS
CRÓNICA que puede ser: no activa, activa leve, activa moderada
y crónica activa intensa.
La displasia leve implica cambios proliferativos evidentes en
el epitelio de revestimiento de las criptas, con glándulas
deformadas con aspecto estrellado y formación de puentes
celulares intraglandulares por la proliferación del epitelio.
La displasia severa se caracteriza por franca estratificación
celular, con núcleos irregulares y con pérdida de
polaridad en el espesor del epitelio; a la displasia severa se
le considera carcinoma in situ. La displasia severa, muestra franca
transformación neoplásica del epitelio gástrico,
delimitada al espesor de la cripta, sin disrupción de la
membrana basal. La displasia severa se clasifica como Tipo I adenomatosa
que se parece al adenoma tubular del colon, acompaña a
la metaplasia intestinal, y es precursor del adenocarcinoma gástrico
de tipo intestinal. La displasia Tipo II que ha sido poco estudiada
no se asocia específicamente a un tipo de adenocarcinoma.
Se ha demostrado que en las gastritis crónicas por H pylori,
el daño de la mucosa por acción de la bacteria no
tiene duda, pero el acelerado recambio del epitelio, quizá
obedezca a que la mucosa está también expuesta a
otros mutágenos, a variaciones individuales en los procesos
de reparación del DNA y a posibles oncógenes. En
los casos de displasias severas no hay duda en diagnosticar neoplasia,
pero en los casos de displasias leves y con regeneraciones atípicas,
los cambios morfológicos obtenidos por microscopia de luz,
requieren de estudios más complejos, como pueden ser marcadores
de proliferación celular y cuantificación de DNA,
con el objeto de intentar determinar el potencial neoplásico
de dichas alteraciones ( 96 ).
|
Foto 13.- Hematoxilina-eosina, 40X.
Zonas de actividad, neutrófilos en la lámina
propia y en las células epiteliales de las glándulas
gástricas.
|
|
Foto 14.- Hematoxilina-eosina 40X. Gastritis
crónica folicular. Se observa un folículo
linfoide con centro germinal hiperplásico. |
|
Foto 15.- Tinción de Genta, 100X,
inmersión en aceite. Numerosos bacilos de Helicobacter
pylori en el moco del epitelio de superficie, se tiñen
de color negro. |
CITOLOGIÁ POR CEPILLADO. La citología mediante
el cepillado de la mucosa gástrica durante las endoscopias,
y posterior observación con técnica de Papanicolau,
es un método que sin duda ha permitido identificar a la
bacteria, pero el mismo cepillado sobre la mucosa gástrica
provoca la ruptura de la capa mucosa y lesiona directamente el
epitelio, por lo que la bacteria queda expuesta a la acción
del ácido gástrico. Esto representa una posible
explicación para la variabilidad de los reportes en relación
a sensibilidades y especificidades, por lo que es un método
que se aplica cada vez menos, además de que el resultado
se informa dos o tres días posteriores a la endoscopia
y de que las variaciones entre los observadores como en todos
los estudios de frotis son evidentes. En la práctica clínica
el método resulta costoso y ha sido sustituido por métodos
no invasivos ( 97 ).
13.2.- PRUEBAS NO INVASIVAS
También llamadas indirectas o no endoscópicas, ya
que sólo requieren de una muestra de sangre, de aire espirado,
saliva, heces u orina, con la ventaja de que son pruebas más
accesibles, que se aplican en situaciones en que no sea fácil
una endoscopia en adultos y sobre todo en niños, teniendo
su máxima utilización en pacientes tratados y se
desea demostrar una erradicación efectiva; en pediatría
para estudiar niños con síndrome de dolor abdominal
crónico y en estudios de muestreo en poblaciones muy específicas.
PRUEBAS SEROLÓGICAS.- Se basan en la identificación
de anticuerpos específicos enfrentados a antígenos
del H pylori, y desde hace varios años, se tiene la posibilidad
de determinar inmunoglobulinas séricas tipos IgG, IgA,
IgM e IgE específicas para H pylori; la inmunoglobulina
predominante en los anticuerpos es la IgG y después la
IgA; el valor de sus cuantificaciones y también sus limitaciones,
es de que sólo permiten conocer exposición a la
bacteria reciente o antigua, por lo que no permiten la discriminación
entre una posible infección activa con exposición
previa e incluso con individuos asintomáticos. De los múltiples
métodos serológicos el que más se utiliza
es el de enzimo-inmuno-análisis ( EIA-ELISA ), que es sencillo,
rápido, que da resultados cuantitativos, por lo que se
pueden establecer diferentes puntos de corte de positividad para
diferentes grupos de población., que seguramente tienen
diferentes prevalencias. Esta prueba mide la respuesta inmune
del hospedero, y no indica la presencia o ausencia de la bacteria
en el momento en que se tomó la muestra, por lo que un
resultado positivo sólo muestra anticuerpos específicos,
y al no confirmar la infección, menos permite eliminar
otra patología gástrica; desde su utilización
las interpretaciones de los resultados, han sido muy cuidadosa,
ya que en países en desarrollo como es el caso de México,
en donde la prevalencia de la infección se de 70 % o más,
las probabilidades de que las pruebas den resultados positivos
son altas, afectando los valores predictivos positivos y en consecuencia
las especificidades. Esto se conoce bien, de ahí que esta
prueba en México, no tenga la utilidad clínica deseada,
al aplicarse en forma general, porque se puede anticipar un resultado
positivo de 65 % o más. La prueba ha sido útil en
países desarrollados con prevalencias menores de infección
por H pylori, por lo que en países en desarrollo, sólo
será aplicable en jóvenes y niños pertenecientes
a las clases socioeconómicas altas, en donde se ha demostrado
prevalencias menores ( 9, 10, 89 ). Existen numerosos preparados
comerciales, que son accesibles en costos, e incluso actualmente
se cuenta con métodos de consultorio, que sólo necesitan
una gota de sangre, obteniéndose resultados inmediatos
y fáciles de interpretar. Con los preparados independientemente
de la razón comercial, se logra una sensibilidad alta de
90 % a 100 %, pero todos tienen una especificidad que es variable
de 76 % a 96 %. La rentabilidad de los estudios serológicos
para monitorizar los resultados de la terapia de erradicación,
se debe relacionar directamente con los niveles de anticuerpos
existentes en la prueba de diagnóstico o muestra pretratamiento
y la de postratamiento; en general se acepta que a las seis semanas
posteriores al tratamiento los niveles de anticuerpos descienden
independientemente de la efectividad de la terapia, y a lo que
se le ha dado máximo valor, es de que a los 6 meses postratamiento,
el descenso ostensible y continuo de anticuerpos, sólo
se mantiene en los pacientes realmente curados ( 36 ). Esta necesidad
de repetir estudios serológicos ha sido una limitante importante,
además de que la prueba de aliento ha mostrado superioridad
en el control de erradicación ( 89 ).
PRUEBA DE ALIENTO O DE AIRE ESPIRADO.- La prueba fue desarrollada
por Graham y Klein en 1987 y la utilización y efectividad
se la da la presencia del mismo H pylori, por la característica
que tiene de producir ureasa y de actuar sobre un aporte de urea
marcada con un radioisótopo, que puede ser C13 O C14, que
se integra al CO2, que se produce al desdoblarse la urea por acción
de la enzima que es exclusiva de la bacteria y de no existir en
la mucosa gástrica. Para la realización de la prueba,
al paciente con 5 o 6 horas de ayuno, se le toman dos o más
muestras basales de aliento que son almacenadas en recipientes
adecuados y cerrados herméticamente, se le hace ingerir
una solución con ácido cítrico, con el objeto
de retardar el vaciamiento gástrico y luego otra solución
o cápsula que contiene 100 mgs. de urea marcada con C13
o C14 ( los dos marcadores son útiles, pero se prefiere
al C13 por su menor costo y no expone a radioactividad ). Si existe
colonización bacteriana la urea se desdobla por acción
de la ureasa del H pylori, liberándose amonio y CO2 marcado
que pasa a la circulación, después es eliminado
por las vías respiratorias; el paciente permanece de preferencia
sentado y a los 30 minutos se toman muestras de aliento en los
mismos reptáculos, se etiquetan y se envían al laboratorio
especializado, donde se cuantificará la presencia del CO2
marcado utilizando un espectrómetro de masas y últimamente
con espectroscopia con rayos infrarrojos. El resultado se informa
en unidades de uso internacional que son la expresión de
los tantos por mil de la relación C13 / C12 de la muestra
basal con respecto a la muestra problema; si la diferencia entre
el valor basal y el valor de 30 minutos, es mayor de 5 unidades,
la prueba se considera positiva y representa infección
actual. Existen en el mercado varias presentaciones, que incluyen
los elementos de trabajo, e incluso existen equipos integrados
para uso en consultorio. La prueba además de identificar
la infección, tiene las ventajas de proporcionar también
respuesta inmediata en estudio de control de tratramiento y de
identificar reinfecciones. Esta prueba no invasiva actualmente
es la más utilizada, recomendada por ser incruenta e ideal
para verificar erradicación, tiene sensibilidad de 88 %
a 100 % y una especificidad de 100 %. A pesar de estas ventajas,
tiene inconvenientes como son: los costos elevados, de que se
necesita laboratorios especializados, de que pueden ocurrir falsas
positivas por la contaminación de otras bacterias productoras
de ureasa, como bacterias orofaringeas que contaminan el sustrato
de urea, sobre todo cuando se administra en solución, por
su presencia en estómagos con aclorhidria secundaria a
gastritis crónica atrófica, y por consumo prolongado
de bloqueadores de la bomba de protones, en donde el llamado medio
hostil ha desaparecido; otro inconveniente es de que también
se presentan falsos negativos , como en el caso de pacientes que
estuvieron en tratamiento, con antibióticos, sales de bismuto
y por supuesto bloqueadores de la bomba de protones; por este
último inconveniente se recomienda suspender todo tratamiento
de supresión de ácido quince días antes del
estudio. Los métodos que miden el CO2 marcado en muestras
de sangre y no en aliento, no han mostrado mejores índices
de sensibilidad y especificidad, además de ser cruentos
por las venopunturas. ( 10, 89 )
ANTÍGENO Ag de H. pylori EN HECES FECALES.- Con base
en la posición aceptada de que el H pylori se elimina por
las heces, el siguiente paso fue el diseñar una prueba
que tuviera capacidad de encontrar antígenos bacterianos
específicos, e incluso se cuenta con equipos comerciales.
A diferencia de las pruebas serológicas que detectan anticuerpos,
la investigación de antígenos en heces, demuestra
de manera directa la presencia de infección, pero no indica
necesariamente, que el cuadro clínico sea por dicha infección.
Tiene además la ventaja de que solo requiere de una muestra
de materia fecal, de ser aplicable sobre todo en pediatría,
en donde para los niños menores es difícil la realización
de prueba de aliento y en donde la endoscopia tiene que tener
indicaciones precisas, además de recursos idóneos
para las endoscopias en pediatría. Desde que se generalizó
su uso se reportan sensibilidades de 94 % y especificidades de
90 %, la utilidad en niños ha sido prometedora y seguramente
lo será en estudios clínicos y epidemiológicos.
Otro valor agregado a la prueba es la de poder confirmar las erradicaciones
postratamiento, sobre todo si la prueba se aplica a partir de
la segunda semana de haber concluido los tratamientos. Dentro
las limitaciones, están sus costos, que a veces la disponibilidad
es difícil, de que el resultado no es inmediato y de que
también tiene resultados falsos negativos, por tratamientos
previos con inhibidores de la bomba de protones, antibióticos
y derivados de bismuto ( 98, 99 ).
ANTICUERPOS EN SALIVA.- A partir del conocimiento de que el H
pylori ha sido identificado en la placa dental, se desarrollaron
pruebas inmunológicas con técnica de ELISA, para
la detección de de anticuerpos IgG contra la bacteria en
la saliva, que se hicieron rapidamente accesibles en costos, y
de poderse aplicar en el consultorio, y sobre todo en la práctica
pediátrica; su máxima utilidad sería en niños
que viven en países desarrollados, por las bajas prevalencias
de la infección , y tal vez también en niños
que viven en países en desarrollo, pero en ambientes de
alto nivel socioeconómico, utilidad derivada de baja probabilidad
preprueba que se esperaría. El inconveniente deriva de
su disponibilidad no es fácil, de que la sensibilidad y
especificidad se han mostrado menores a las reportadas en las
pruebas serológicas, y a la fecha la prueba no ha tomado
lugar en el trabajo clínico, incluso en pediatría
que sería lo ideal ( 100 ).
ANTICUERPOS EN ORINA.- Como la determinación de anticuerpos
en saliva, la determinación en orina, puede ser útil
en comunidades donde la prevalencia de la infección es
baja; también se considera que su máxima utilidad
es en niños, su sensibilidad es aceptable, pero tampoco
está claro que pueda ser una prueba utilizable para conocer
erradicaciones postratamiento, además de que los anticuerpos
pueden permanecer por más de un año en muestras
de orina ( 101 ).
REACCIÓN DE POLIMERASA EN CADENA ( RPC ).- La reacción
en cadena de la polimerasa ( polymerasa chain reaction PCR ) representa
una biotecnología que logra amplificar o reproducir in
vitro un número de copias de una región específica
del ADN, con la finalidad de reproducir cantidad suficiente de
un fragmento para su evaluación, y a su alta especificidad
y sensibilidad, se debe su utilización en el diagnóstico
de virus, parásitos y bacterias de dificil cultivo, como
es el caso del H pylori, ofreciendo un diagnóstico confiable,
rápido y menos laborioso que los cultivos normales, con
la ventaja adicional, de que la cantidad de material necesario
para el inicio de la reacción es muy pequeña, ya
que sólo es necesario la cantidad de ADN contenida en una
sóla célula. Se han reportado diferentes métodos
moleculares para detectar la presencia de H pylori en biopsias,
saliva, jugo gástrico y heces, pero para su realización
como método diagnóstico, requiere de tecnología
y equipos altamente especializados, por lo que su utilización
se ha limitado ha investigaciones, permitiendo conocer características
de las cepas infectantes, principalmente la virulencia y las resistencias
a los antibióticos. Por la existencia de múltiples
cepas y con variabilidad genética, su utilidad en la clínica
es limitada, teniendo sus aplicaciones para conocer las cepas
infectantes de diversos grupos humanos, para el estudio de contaminación
por H pylori en aguas potables, e incluso ha permitido determinar
corrientes migratorias intercontinentales. Sin duda es una prueba
de alta sensibilidad y especificidad, pero la limitación
son los costos y su disponibilidad mínima ( 102 ).
Es importante señalar que la selección de las pruebas
diagnósticas para apoyar el diagnóstico de infección
por H pylori, no es pensando en cual es la mejor de todas, sino
seleccionarla con base a estudio clínico, conocimiento
de prevalencias de la zona donde se trabaja, niveles socioeconómicas
y sobre todo disponibilidad por recursos y costos. Esto último
es importante, ya que los costos implican disponibilidad en función
de niveles de atención, como en el caso de pruebas invasivas,
que ameritan gabinetes de endoscopia perfectamente equipados;
y de las no invasivas como en el caso de la prueba de aliento,
en México, tienen las limitaciones del costo y de la alta
prevalencia de infección, por lo que se puede anticipar
altos resultados positivos y no necesariamente por infección
activa, en el momento de la prueba. Lo mismo se puede decirse
para las pruebas serológicas que aunque por costos son
accesibles, se pueden anticipar también altos resultados
positivos ( prevalencia a priori ) por la frecuencia de cicatrices
serológicas ( 103 ).
En conclusión los conocimientos actualizados de la infección
por el H pylori, el estudio clínico, la situación
de cada paciente, las edades, los niveles de atención,
los recursos disponibles y los costos, permiten una selección
de adecuada de cada prueba y para cada paciente, e incluso indicar
un tratamiento de erradicación sin llegar a la endoscopia,
y esta emplearla sólo con justificación plena. De
los métodos invasivos destacan el estudio histopatológico,
considerado como el estándar de oro, la prueba de ureasa
rápida y el cultivo, con las ventajas de que diagnostican
infección y enfermedad, con sensibilidad reportada desde
80 % hasta 90 %, y especificidad de 95 % a 100 %; los estudios
no invasivos tienen la ventaja de que son económicos, pero
con la gran desventaja de que sólo diagnostican infección
y no enfermedad, reportándose sensibilidad de 86 % a 96
% y especificidad de 74 % a 98 % ( 103 ).
14.- TRATAMIENTO DE LA INFECCIÓN POR HELICOBACTER
Como ya se mencionó, la presencia de del H pylori se hace
evidente sólo en los sitios donde existe mucosa gástrica,
por supuesto en el estómago, en zonas de ectopia como en
el divertículo de Meckel y en el colon, y además
en zonas de metaplasia de la mucosa gástrica en el duodeno
y en el epitelio de Barrett. Desde las publicaciones de Marshall
y Warren en 1983 de la presencia de la bacteria en la mucosa gástrica,
se derivaron cambios sustanciales en el conocimiento de la etiopatogenia
de las gastritis, y algo que fue de gran impacto, al aceptarse
el hecho de que las úlceras pépticas duodenales
y gástricas, tienen como factor etiopatogénico importante
a una infección, lo que empezó a desplazar a los
aceptados con anterioridad, por lo que se iniciaron los tratamientos
con base a dos hechos: la aplicación de bactericidas y
la supresión del ácido del micronicho del H pylori.
La primera consideración que se tuvo en cuenta, fue el
reconocimiento de que la infección por H pylori representa
a la afección crónica más frecuente en el
ser humano, y superada sólo por las caries dentales, de
llegar a tener prevalencias hasta del 90 % en países en
desarrollo y de que sólo el 10 % a 20 % de los individuos
infectados tienen enfermedad sintomática, situación
que indudablemente dependerá de factores del hospedero
y de la virulencia de las cépas infectantes; pero además
y en pocos años se asociaron otras patologías extradigestivas
y como ejemplos: enfermedades vasculares, urticarias idiopáticas,
glaucoma crónico de ángulo abierto, y que han mejorado
con tratamientos de erradicación, mejorías con soporte
estadístico en relación a grupos controles. Esto
implicó que desde que se inició la era del Helicobacter
Pylori, surgieran las preguntas clásicas que todos los
investigadores se hicieron, y se siguen haciendo aún en
el año 2007. ¿ Por qué utilizar antibióticos
y por que asociarlos a un bloqueador de la producción del
ácido gástrico ? ¿ Cual sería el tratamiento
ideal ? ¿ A quién dar tratamiento ? ¿ Por
quien ? ¿ Con qué ? ¿ Como ? ¿ Con
que controles ? ¿ Por qué fallan los tratamientos
? ¿ Qué se hace cuando no se logra la erradicación
? (104 )
14.1.- TRATAMIENTO EN ADULTOS
¿ POR QUÉ DAR TRATAMIENTO ? Desde el reporte de
Marshall, codescubridor de la bacteria, y que comprobó
que su eliminación, era seguida de una disminución
importante de las recidivas ulcerosas a un año de seguimiento;
a partir de dicho momento, los múltiples trabajos y con
evidencias científicas, han demostrado que los antibióticos
asociados a bloqueadores H2 y después los inhibidores de
la bomba de protones, aplicados en esquemas, en días suficientes
y adecuados seguimientos, cicatrizan las úlceras duodenales,
sobre todo en pacientes H pylori +, desapareciendo el concepto
de úlceras refractarias, disminuyendo las recidivas, las
complicaciones, y pasando casi a la historia las vagotomías
y las resecciones gástricas. También existen múltiple
bibliografía que demuestra que los correctos tratamientos
de erradicación, dan beneficios en costos de la medicación,
en la disminución de ausentismos laborales, en hospitalizaciones,
y sobre todo en la mejoría de la calidad de vida de los
enfermos ulcerosos actuales ( 105, 106, 107, 108 ).
¿ CÚAL SERÍA EL TRATAMIENTO IDEAL ? Actualmente
se acepta por la experiencia internacional, en base a la de los
investigadores nacionales y por consensos, y que además
los puso de moda el H pylori, el tratamiento ideal, es aquel que
se acerque a un 90 % de erradicación de la bacteria de
los sujetos infectados, independientemente de las situaciones
clínicas que motivaron la investigación médica,
con efectos colaterales relacionados a los medicamentos que no
pasen el 5 %, de que los esquemas aplicados sean accesibles, que
faciliten el cumplimiento y apego, de corta duración (
7 a 14 días ), en combinación de fármacos
con bajo costo, y lo más importante, con mínimas
resistencias conocidas y que no las favorezcan. En general se
acepta que por las experiencias y los resultados que se tienen,
casi se está logrando el ideal ( 104, 107 ).
¿ A QUIÉN DAR TRATAMIENTO ? La contestación
a esta pregunta ha cambiado con los años, así para
1990 y en el Congreso Mundial de patología Digestiva celebrado
en Sydney, las recomendaciones terapéuticas se centraron
en la enfermedad ulcerosa, recomendando tratar a todo paciente
que tuviera dos o más ataques ulcerosos por año
y que hubiera seguido tratamientos con antisecretores de ácido,
en úlceras refractarias, en recidivas a pesar de tratamientos
de mantenimiento, antes de decidirse por un tratamiento quirúrgico
( excepto en indicación quirúrgica por complicaciones
y urgencias ). En 1994, el Instituto Nacional de Salud de EEUU,
emitió la recomendación de dar tratamiento de erradicación
en todo paciente ulceroso e infectado por H pylori, insistiendo
en los antibióticos seleccionados y probados en relación
a resistencias bacterianas. Recomendación que es admitida
en la reunión de Maastrich I en 1996, y por la Conferencia
de Consenso del Grupo Europeo para el estudio del H pylori, estableciendo
tres categorías de tratamiento, basándose en las
experiencias acumuladas a nivel mundial: 1 muy recomendada, 2
aconsejable y 3 dudosa, y también tres categorías
relacionadas con la fuerza de las evidencias cieníficas:
A inequívoca, B de apoyo y C equívoca; siguiendo
estas categorías se elaboraron las siguientes directivas
de erradicación del H pylori para diferentes situaciones
clínicas ( TABLA 3 ) ( 109 ).
| Tabla
3 – Tratamientos de erradicación de Helicobacter
pylori |
| ENFERMEDAD |
RECOMENDACIÓN |
EVIDENCIA |
| Ulcera duodenal y gástrica |
1 |
A |
| Linfoma MALT |
1 |
A |
| Gastritis severa |
1 |
B |
| Resección de carcinoma in situ |
1 |
B |
| Dispepsia funcional |
2 |
C |
| Historia familiar de adenocarcinoma gástrico |
2 |
C |
| ERGE en tratamientos prolongados con omeprazol |
2 |
B |
| Necesidad de tratamiento con AINE |
2 |
C |
| Estómago operado por enfermedad ulcerosa |
2 |
B |
| Individuos Asintomáticos |
3 |
C |
| Patologías extradigestivas |
3 |
C |
Se aprecian situaciones en donde las indicaciones de tratamientos
justificados de erradicación, persisten hasta la fecha,
y otras que a la fecha han sido motivo de múltiples estudios,
con resultados opuestos y que siguen siendo motivo de controversia,
como lo siguen siendo las dispepsias no ulcerosas o funcionales,
el papel positivo o no de ayuda de la erradicación de la
bacteria en los pacientes necesitados de tratamientos con AINE´s,
para prevenir las úlceras y sobre todo las complicaciones.
Sin duda también han existido controversias y resultados
contradictorios, ante la posibilidad de que a los tratamientos
exitosos de erradicación del H pylori, han seguido un aumento
indudable de la enfermedad por reflujo gastroesofágico
( ERGE ) y sus complicaciones, sobre todo el epitelio de Barrett
( 19 ). En la tabla se aprecia que en casos de patologías
extradigestivas y vinculadas a la coincidencia o posible asociación
a la infección por H pylori, la recomendación de
tratamiento de erradicación representa una utilidad dudosa
y con una evidencia científica equivoca, pero después
de 1996, la lista de las patologías extradigestivas sigue
aumentando, no disminuye y se siguen prestando controversias;
un ejemplo lo es la preocupación de investigar la razón
de sobrepeso en las poblaciones de primer nivel de desarrollo,
que ha seguido a menos prevalencias de infección, y que
al contrario en los infectados, con gastritis de grado variable,
los niveles de producción de ghrelina están disminuidos
( 85, 86 ). Al año siguiente en 1997, se publican los resultados
del trabajo de la primera reunión del Grupo Nacional del
Consenso Mexicano sobre HELICOBACTER pylori, los cuales se centran
en varias líneas de investigación para determinar
en la población nacional, adulta y pediátrica, y
con gastritis crónica activa asociada a H pylori: tipo
de cepas, manifestaciones clínicas, los patrones histopatológicos,
los factores comorbidos ( AINE, alcohol, tabaquismo, dietas, reflujo
alacalino, etc. ) para conocer la historia natural de la infección,
de las gastritis y las respuestas al tratamiento de erradicación.
Pero lo más significativo de los trabajos, es de informar,
que la asociación de la úlcera péptica duodenal
y gástrica y H pylori es una realidad, pero que es probablemente
causal y no específica, y que puede depender de la cepa
infectante; es decir que en la úlcera péptica, la
bacteria no es el único factor, sino que existen otros
factores etiopatogénicos coexistentes, como la edad, el
género, la carga de ácido que llega al duodeno,
la densidad de células G productoras de gastrina, y el
tabaquismo; además de que puede haber úlceras sin
infección por H pylori, como las secundarias a los AINE´s,
las úlceras de estrés duodenales, y las del síndrome
de Zollinger Ellison. Otras líneas de investigación
sugeridas: determinar la coexistencia de metaplasia gástrica
en el duodeno con úlceras duodenales y la utilidad de biopsias
de mucosa del duodeno, la prevalencia de úlceras duodenales
asociadas a H pylori en infantes, conocer las cepas asociadas
a adenocarcinoma y linfomas, determinar la frecuencia de linfomas
de bajo y alto grado con evaluaciones inmunohistoquímicas,
determinar las tasas de erradicación y de reinfecciones
en grupos tratados e investigaciones permanentes sobre sensibilidades
de las cepas aisladas, en relación a los antibióticos
prescritos o nuevos. Por supuesto ya se mencionan la importancia
de los esquemas de tratamiento a base de antisecretores, dos antimicrobianos
y con duraciones de siete a catorce días ( 105 ). Desde
que se hizo el descubrimiento de la bacteria en 1983, se han organizado
varios concensos con la intención de aclarar las situaciones
clínicas que ameritan tratamientos de erradicación
( el mexicano, los Maastricht I, II y III, el americano, el europeo
y el de la región oriental-pacífico ), al considerar
que por ser una infección tan generalizada, las indicaciones
para dar tratamientos, deben establecerse por indicaciones precisas,
ya que se acepta no ser práctico utilizar recursos económicos
para tratar a personas que sólo son portadores asintomáticos
y que no padecen una patología específica. Actualmente
se acepta que el tratamiento erradicador se aplique en las siguientes
situaciones:
-
Úlcera gástrica o duodenal,
activa o no activa, complicada o no complicada. En presencia
de complicaciones, primero tratarlas y después el tratamiento
-
Linfoma gástrico tipo B de la zona
marginal asociado a mucosas ( MALT )
-
Gastritis atrófica y metapalsia intestinal
-
Pacientes gastrectomizados por adenocarcinoma
y colonización por H pylori en el remanente gástrico
-
Pacientes con historia familiar de primera
línea con adenocarcinoma gástrico
Persistiendo controversias y criterios no concluyentes para recomendar
tratamientos de erradicación, cuya lista persiste y son
considerados en trabajos de investigación:
-
En individuos infectados y asintomáticos
-
En dispepsia no ulcerosa o dispepsia funcional
-
Terapéutica prolongada con inhibidores
de la bomba de protones
-
Terapéutica prolongada con AINE´s
en pacientes con antecedente de úlcera péptica,
con o sin complicaciones y factores de riesgo asociados: tabaquismo
y consumo de alcohol
-
Situaciones de hipersecresión como
en el síndrome de Zollinger Ellison
-
En patologías extradigestivas: por
consenso sólo se recomienda tratamiento en pacientes
con anemia por deficiencia de hierro y en púrpura trombocitopénica
idiopática
-
La conducta que se ha preconizado de probar
tratamientos de erradicación y empíricos, cada
vez se recomiendan menos ( 110 ).
El consenso mexicano sobre actualidades sobre H pylori 2007,
indica que no se recomienda el tratamiento de erradicación
en las siguientes indicaciones:
-
Dispepsia funcional
-
Enfermedad por reflujo gastroesofágico
-
En el embarazo y la lactancia por seguridad
-
En cardiopatía isquémica,
rosacea, halitosis, retraso en el crecimiento y urticaria crónica
¿ QUIÉN DEBE DAR EL TRATAMIENTO
? La responsabilidad de tratar a los pacientes infectados por H
pylori y con sintomatología atribuible a la bacteria, al
principio se centró en el internista y en el gastroenterólogo,
en un ámbito de atención muy especializado, de donde
han surgido los trabajos formales relacionados a la efectividad
de los esquemas de tratamiento; pero el interés sobre la
infección se extendió a los médicos de atención
primaria, por lo que actualmente se acepta que el tratamiento también
lo deben aplicar los médicos generales que hubieran adquirido
la información y la preparación adecuadas, siguiendo
ciertas pautas relacionadas a la utilización ordenada de
pruebas diagnósticas, principalmente las no invasivas como
la prueba de aliento y la investigación de antígeno
en heces fecales ( 111 ).
¿ CON QUÉ ? El enfoque terapéutico de la
infección por H pylori, ha sido revisado constantemente,
considerando que aún cuando la bacteria es sensible a un
número importante de antibióticos y no antibióticos
in vitro, no siempre lo son in
vivo, debido a varios factores como son: a que el
antibiótico no alcance las zonas del epitelio gástrico
colonizado, a que sea inactivado por el pH gástrico, a
que las condiciones del habitat de la bacteria no son reproducibles
en el laboratorio y sobre todo al desarrollo de resistencias por
el uso indiscriminado de antibióticos. La infección
actualmente se ha tratado con: antibióticos, antimicrobianos
y antisecretores del ácido gástrico.
ANTIBIÓTICOS.- Seleccionando a los que han mostrado utilidad
in vitro y sobre todo in
vivo con tolerancias adecuadas y menores resistencias.
Betalactámicos.- De estos en primer lugar la amoxicilina,
que se ha utilizado con éxito en esquemas triples y cuádruples,
además de que es el antibiótico al que se le han
reportado las menores resistencias bacterianas, de 0 a 0.9 % en
el mundo y en México de 0 a 18 %. Macrólidos.- La
claritromocina ha tenido gran aceptación, sobre todo en
esquemas triples, es bien tolerado, y los reportes de resistencias
bacterianas llegan a cifras de 4 % a 32 % en el mundo y en México
de 8 a 25 %.
Tetraciclinas.- La limitación de su uso es la intolerancia
y no poderse utilizar en esquemas de erradicación en pediatría;
las resistencias son raras y se reportan cercanas a las de la
claritromicina, pero menores. Se ha utilizado en pacientes que
son alérgicos a las penicilinas sustituyendo a la amoxicilina,
a dosis de 500 mgms. cuatro veces al día, reportándose
resistencias bacterianas de de 0 a 5.3 % en el mundo, desconociéndose
las cifras en México.
Otros antibióticos.- Se han utilizado ciprofloxacinas
y azitromicinas, que son más caros y no han mostrado ser
superiores a los mencionados. Últimamente se ha utilizado
el levofloxacino que es un antibacteriano sintético perteneciente
al grupos de las fluorquinolonas, con resultados más prometedores
( 112, 113 ).
Nitroimidazoles.- El más utilizado el metronidazol, y
desde que se iniciaron los esquemas de tratamiento, sólo
y en esquemas dobles, triples y cuádruples, pero los reportes
de resistencias muestran un aumento progresivo con los años,
desde que se inició su utilización, con cifras de
15 a 62 % en el mundo, y en México de 40 a 76 %, lo que
justifica que en México ya no debe ser prescrito y ser
sustituido, utilizando el tinidazol y la furazolidona ( 105 ).
ANTIMICROBIANOS.- Que actúan en forma tópica sobre
la mucosa gástrica. ( revisar )
FURAZOLIDONA.- Es un nitrofurano sintético de amplio espectro,
que se ha utilizado por su efectividad sobre cepas resistentes
al metronidazol y en esquemas de recuperación cuando se
han detectado recidivas. Se ha utilizado en dosis de 100 mgms.
cuatro veces al día y por compartir algunos efectos adversos
del metronidazol, amerita más estudios para conocer su
verdadera valía clínica.
SALES DE BISMUTO.- Se tiene experiencia con subsalicilato y principalmente
con el subcitrato de bismuto, siendo útiles en esquemas
triples y cuádruples, con la ventaja de que no se han informado
resistencias. Fármacos que mostraron su utilidad desde
el inicio de la era del H pylori, incluso en esquemas iniciales
como monoterapia, pero las tasas de éxito de erradicación,
no pasaron de 50 %, por lo que rapidamente se asoció a
otro fármaco, apareciendo la conocida asociación
de bismuto-ranitidina, y que ctualmente se aplica asociada a uno
o dos antibióticos, sobre todo en sistemas de atención
que no cuenten con bloqueadores de bomba de protones, representando
una acción útil, ya que aun cuando se pierde eficacia
en la supresión del ácido, se gana por el efecto
bactericida del bismuto. ( 105, 114 )
ANTISECRETORES.- Los bloqueadores de receptores H2 de la histamina
se utilizaron desde los trabajos de de Henstschal en 1993, en
que comunicó los resultados del tratamiento erradicador
del H pylori empleando un esquema triple: ranitidina, amoxicilina
y metronidazol, obteniéndo éxito en el 89 % de los
pacientes tratados, resultados que no se alcanzaron en publicaciones
posteriores. Después se utilizaron los bloqueadores de
la bomba de protones, iniciándose la experiencia con el
omeprazol, con la ventajas de ser primero un potente antisecretor
del ácido gástrico, pero también por tener
un efecto directo sobre la bacteria, al bloquear la bomba de protones
de la misma bacteria. A partir del omeprazol, se han utilizado
otros tipos de inhibidores de la bomba de protones ( en relación
a factores de competencia por las empresas farmacéuticas
): pantoprazol, lansoprazol, rabeprazol, esomeprazol, los cuales
no tienen diferencias significativas en su utilización
en esquemas asociados a otros dos o tres fármacos ( 107
).
¿ CÓMO TRATAR ? El objetivo de los tratamientos
debe ser la erradicación de la bacteria, que representa
una infección, independiente a que esté ocasionando
una enfermedad o condición patológica. Desde que
se iniciaron los esquemas terapéuticos, se recomendaron
normas como simplicidad, tolerancia, fácil cumplimiento
y sobre todo una eficacia erradicadora por arriba del 85 % en
un análisis de intención de tratar, o de 90 % en
trabajos de protocolo, y con duraciones de 10 a 14 días.
Actualmente los esquemas que cumplen con la normatividad derivada
de consensos son los triples de inicio y cuádruples en
situaciones de fallas por resistencias y/o recidivas ( 109 ).
El esquema triple de primera línea y que más se
ha utilizado en México, está avalado por dos hechos:
uno, que las cepas infectantes en el país son más
resistentes al metronidazol y a la ampicilina, que las infectantes
en EEUU y Europa, como lo demostró Margarita Dehesa desde
1997; y el segundo hecho, de que los antibióticos que efectivamente
eliminan a la bacteria no son muchos, por lo que se debe ser muy
cuidadoso en la elección. Como ya se mencionó el
metronidazol ya no debe formar parte de los esquemas terapéuticos,
y por las publicaciones que se tienen a nivel nacional, el esquema
con el que se tiene más experiencia se integra con: inhibidor
de bomba de protones: omeprazol 20 mg, pantoprazol 40 mg, lansoprazol
30 mg, esomeprazol 40 mg, o rabeprazol 20 mg cada doce horas y
dos antibióticos: amoxicilina 1 gmo y claritromicina 500
mg cada 12 horas y por 14 días. Otro esquema de primera
aplicación recomendable se integra por ranitidina bismutada
( ranitidina 150 mg y citrato de bismuto 250 mg ) cuatro veces
al día, amoxicilina 1 gm dos veces al día y claritromicina
500 mg dos veces al día, y también por 14 días.
En general se recomienda al terminar el esquema de primera línea,
continuar tratamiento con ranitidina o bloqueadores de la bomba
de protones por cuatro semanas, suspenderlos por dos antes de
efectuar una prueba de control de erradicación no invasiva,
de preferencia prueba de aliento ( 107 ).
¿ CON QUE CONTROLES ? El criterio de eficacia para valorar
la respuesta al tratamiento de erradiación empleado, está
dado por tres hechos: uno, la patología que acompañó
a la infección, como la cicatrización de la úlcera
duodenal o gástrica, la mejoría de las alteraciones
histopatológicas en caso de las gastritis crónica
cuando no habían llegado a las no reversibles y la regresión
de los linfomas gástricos de bajo grado tipo MALT; el segundo
representado por la mejoría de clínica que manifieste
el paciente y la más importante por tratarse de un tratamiento
de una infección por la desaparición de la bacteria.
Esto se realiza mediante pruebas no invasivas, correspondiendo
a la más recomendada y utilizada, que es la prueba de aliento
efectuada de cuatro a seis semanas de haberse terminado el tratamiento;
una prueba negativa implica curación, y lo contrario un
resultado positivo implica fracaso y que debe investigarse. La
otra prueba no invasiva que se recomienda como control de erradicación,
esta representada por la investigación de antigenos del
H pylori en heces, cuya máxima utilización es actualmente
en pediatría, para edades en que no es fácil realizar
una prueba de aliento; la limitante principal es la necesidad
de laboratorios especiales, lo que incrementa los costos y disminuye
su utilidad ( 109, 115 ).
¿ POR QUÉ FALLAN LOS TRATAMIENTOS ? Los factores
relacionados a los resultados de fracaso y que más se mencionan
son: falta de apego al tratamiento por incumplimiento del paciente,
falta de supervisión y de orientación por parte
del médico, por efectos adversos de los medicamentos y
por resistencias bacterianas. Los efectos adversos a los medicamentos
son frecuentes, pero sólo en el 10 % de los casos son motivo
de la suspensión del tratamiento; los más mencionados
se relacionan al metronidazol, con sabor metálico, neuropatía
periférica, cefalea y mareo; trastornos dispépticos
por claritrominina, alergias y diarreas por amoxicilina, fotosensibilidad
y problemas del esmalte dentario por tetraciclinas; los efectos
adversos a las sales de bismuto a las dosis terapéuticas
son realmente raros. El último factor como falla en el
tratamiento de primera intención, relacionado a las resistencias
bacterianas, se reporta del 5 % al 12 % de los trabajos al respecto
y obliga a un segundo esquema de tratamiento ( 113, 115 ).
¿ QUE SE HACE CUANDO FALLAN LOS TRATAMIENTOS ? En todos
los esquemas de tratamiento de primera línea, se reportan
fallas de erradicación, por lo que un segundo esquema debería
basarse en estudios de cultivos y de resistencias bacterianas,
lo cual en la práctica clínica diaria no es fácil
de lograr, pero sí se está de acuerdo, en que no
deben repetirse los antibióticos del primer esquema ( amoxicilia
y claritromicina ), ya que las cifras de erradicación difícilmente
pasarían de 50 %. También se está de acuerdo
en utilizar los esquemas cuádruples a base de un antisecretor
a dosis dobles, tetraciclinas 500 mg cuatro veces al día,
furazolidona 100 mg cuatro veces al día con duración
de 14 días, lo que permite cifras de erradicación
hasta del 77 % ( 116 ). Al considerarse que los esquemas cuádruples
son complicados para un correcto cumplimiento, actualmente se
han propuesto nuevos esquemas triples para, eliminar cepas resistentes
a los antibióticos más utilizados, recomendándose
esomeprazol 40 mg, moxifloxacina 400 mg y rifabutina 300 mg dos
veces al día y por 7 a 14 días; otro esquema triple
que se ha recomendado es el de un inhibidor de bomba de protones,
amoxicilina 1 gm con levofloxacino 500 mg dos veces al día
y por 7 a 14 días. Con estos esquemas de rescate se reportan
efectividades que alcanzan el 80 % ( 117 ). Por supuesto que no
hay duda que la indicación de una segunda línea
de erradicación, deberá estar basada en cultivos
de biopsias de mucosa gástrica durante endoscopias para
investigar susceptibilidades a los antibióticos, pero por
razones económicas, dicha conducta en la práctica
se debe seguir en centros de investigación ( 115, 116,
117 ).
14.2.- TRATAMIENTOS EN PEDIATRIA
Se conoce que la infección se adquiere desde la infancia
temprana y sobre todo en los países en desarrollo como
es el caso de México, y los lineamietos de tratamiento
derivados por consensos internacionales como el Maastricht 3-
2006 y de trabajos en instituciones de atención pediátrica
oficiales y de seguridad social del sector salud nacional, relacionados
a cuadros dispépticos, de dolor abdominal crónico
recurrente ( SDCR ) y de úlceras pépticas, se tienen
puntos de acuerdo. En los niños no se tienen evidencias
definitivas de poder asociar la presencia de gastritis por H pylori
con síntomas dispépticos y con los cuadros de dolor
abdominal crónico recurrente; la excepción es en
la demostración inobjetable de úlcera péptica;
no se recomienda le investigación de pruebas diagnósticas
no invasivas en los niños con síntomas dispépticos,
ya que se ha demostrado que con la erradicación de la bacteria,
no se logran alivios sintomáticas en la mayoría
de los casos; la única manera de estudiar a los pacientes
pediátricos con evidencias de patologías digestivas
es mediante endoscopia, que esté plenamente justificada,
después de hacer un estudio de diagnóstico diferencial
integral, y mediante la gastroscopia obtener múltiples
biopsias para pruebas de ureasa rápida, estudios histológicos
y cultivos. En niños con infección demostrada por
este medio invasivo, con y sin úlcera péptica se
debe dar tratamiento de erradicación con esquema triple
a base de inhibidores de la bomba de protones,y dos antibióticos
como amoxicilina y claritromicina a dosis ajustadas al peso y
por 7 a 14 días ( 118, 119 ).
LAS RECURRENCIAS DE INFECCIÓN.- Es importante considerar
que siempre existen posibilidades de reinfección de la
colonización bacteriana después de tratamientos
exitosos perfectamente comprobados, lo que se ha apreciado más
en las poblaciones pedíatricas, reportándose indices
de recurrencias hasta de 24 % para niños mayores de 10
años; en adultos los estudios han mostrado que las probabilidades
de estar libre de infección a un año es de 94.7%
y cinco años de 90.7 %, lo que implica recurrencia de 2.6
% por paciente año. En general se acepta que el porcentaje
de reinfección en países desarrollados es de 3 %
a 8 % a un año, y en países en desarrollo las recidivas
son más altas con 8 % al primer año, 11 % al segundo
y hasta el 13 % o más a partir del tercer año (
104 ). En México se han reportado recurrencias de infección
del 13 % por año y de la úlcera péptica de
3.5 % por año ( 104 ). También se ha sugerido que
al conocerse que la mayoría de las recurrencias ocurren
dentro del primer año, estas pueden ser recidiva de la
infección y no verdaderas reinfecciones, y que dichas recidivas
al presentarse con más frecuencia en pacientes jóvenes,
esto puede deberse a fallas en apego al tratamiento( 116, 117
).
14.3.- POSIBILIDADES DE UNA VACUNA
Si consideramos que una bacteria es la causa de la infección
más extendida en el mundo, de conocer las consecuencias
de su colonización crónica en el estómago
de los humanos, y las dificultades de su tratamiento por la necesidad
de esquemas complejos de erradicación con antibióticos
de los que no hay mucho de donde seleccionar, el siguiente paso
sería el de contar con una vacuna que pudiera desarrollar
inmunidad específica contra el H pylori. Esta sin duda
es una expectativa del futuro y que actualmente se encuentra en
fase de investigación, y de que seguramente transcurrirán
varios años para que se tenga un biológico efectivo,
tolerable y con costos accesibles. Existen grupos que están
trabajando en modelos animales principalmente ratones, cerdos
y primates de diferentes especies y con la ventaja de que están
infectados por lo que puede llamarse su propio HELICOBACTER como
el nemestinae de monos macaco, suis de cerdos, mustelae de hurones
y el más reciente modelo de Helicobacter pylori-ratones
que mimetiza la infección humana, etc. Las investigaciones
se centran en aprovechar los conocidos mecanismos inmunológicos
naturales de la mucosa digestiva, para lograr una apropiada vacuna
para inmunización oral, siguiendo el camino de los mecanismos
inmunológicos, que utilizan todas las mucosas incluyendo
las del tracto digestivo. Es decir que el antígeno de una
vacuna administrada por vía oral, es captado por las células
M y transportado a las células presentadoras de antígenos.
En este paso el adyuvante de la vacuna es importante, porque estimula
la transformación de células Th1 a células
Th2, que promueve la expansión clonal de linfocitos B,
de las que derivan las células plasmáticas y que
son las productoras del antígeno IgA. La respuesta inmune
a la inmunización anti- H Pylori pretende conseguir la
estimulación de forma dirigida de las células Th2,
diferenciándose de la respuesta inmune natural de la infección
por la bacteria, en donde la respuesta inmunológica al
estímulo bacteriano es de células Th1. En la aplicación
real se debe considerar que los anticuerpos parecen no ser tan
importantes en la protección, como si lo serían
los linfocitos T sobre todo los CD4+, aunque cuesta trabajo explicar
un efecto celular directo de protección, por la localización
de los micronichos de colonización en la superficie epitelial.
El componente antigénico para ser usado como vacuna debe
reunir ciertas características como son: ser factor patógeno
de virulencia, evitar la aparición de mutantes deficientes
en la expresión del antígeno, de estar presente
en la superficie de la bacteria para ser accesible a la respuesta
inmune, tener expresión en todas las cepas y tener la capacidad
de inducir respuesta inmune en un modelo animal. El problema que
se reportan en los intentos de desarrollar una vacuna, es la necesidad
de un adyuvante mucoso seguro, ya que los actuales poseen un alto
grado de toxicidad, por lo que la destoxificación o el
uso de bajas dosis de los adyuvantes, podrán ser de utilidad.
Se han investigado varios componentes bacterianos como antígenos
en esquemas de inmunización en modelos animales: la ureasa
de la bacteria en sus dos subunidades A y B, las proteinas de
choque térmico HspA y HspB, la VacA ( citotoxina vacuolizante
) y la proteina CagA, entre otros. Estos antígenos son
producidos mediante técnicas recombinants y expresados
en bacterias acarreadoras como cepas avirulentas de Salmonera
typhymurium, antígenos bacterianos que son administrados
conjuntamente con adyuvantes de mucosa como la toxina termolábil
( TL ) y la de Escheriquia coli ( 115, 117, 120 ).
Los trabajos de investigación han mostrado que si se administra
una vacuna oral a un animal no infectado, se obtiene un efecto
profiláctico; si el estómago del mismo animal está
previamente infectado, la vacuna tiene un efecto curativo, por
la respuesta inmune. En la aplicación humana, se espera
lograr la vacuna segura para utilizarse en la clínica y
en dos vías, la profiláctica y la curativa, derivando
también dos interrogantes: ¿ A quién y a
que grupo poblacional aplicar ¿ y ¿ A qué
edad debe aplicarse ¿ De inicio parecería que los
niños en edad escolar serían los candidatos a vacunar
( 121 ). Considerando las evidencias epidemiológicas que
han demostrado que la infección se adquiere desde edades
tempranas, la vacunación en programas de gran cobertura,
se perfila como una gran campaña de actividad sanitaria,
para evitar las infecciones iniciales y evitar las consecuencias
funestas que puedan tener los portadores. Por lo que antes de
empezar a pensar en costos, hay que tener primero la vacuna, lo
cual seguramente se logrará ( 121 ).
15.-LA INFECCIÓN POR HELICOBACTER pylori COMO
PROBLEMA DE SALUD EN MÉXICO
Se conocen cifras reportadas de prevalencia de infección
por H pylori que van del 70 % al 90% en países en desarrollo,
de 30 % a 35 % en los desarrollados y de 50 % para toda la población
mundial. De todos los infectados del 10 % al 20 % serán
sintomáticos desarrollando patologías gastroduodenales
y de estos el 3 % tendrán en un momento de su vida, altas
posibilidades de presentar carcinoma gástrico, neoplasia
que ocupa el segundo lugar en incidencia a nivel mundial, sólo
después del carcinoma de pulmón, con más
de 800,000 casos nuevos diagnosticados cada año, correspondiendo
el 60 % a los países en desarrollo como México.
En los países desarrollados se tienen evidencias de una
disminución constante de las prevalencias de la infección
por H pylori, con tasas de declinación hasta de 26 % por
década y sólo el 0.4 % de adultos no infectados,
adquieren la bacteria cada año, lo que se ha acompañado
de disminución de la enfermedad ulcerosa y del carcinoma
gástrico, situación que ha sido muy evidente en
los EEUU en donde las tasas de mortalidad por dicha neoplasia
en hombres caucásicos fue de 40 X 100,000 en 1930, para
disminuir a 5.8 X 100,000 en el período comprendido de
1997 al 2001 ( 122, 123 ). En México se acepta una prevalencia
de infección del 70 %, lo que indica que de una población
de 105 millones de habitantes, pueden existir 70.35 millones de
infectados, de los cuales por lo menos el 10 % que son 7.35 millones
podrán ser o son pacientes sintomáticos, que asisten
a atención médica en los diferentes sistemas de
atención y que son más de diez, representando una
carga económica que a la fecha no ha sido calculada; y
de estos el 3 % que representan 219,900 podrán ser individuos
con cinco a seis posibilidades mayores de integrar la lista de
casos nuevos de adenocarcinoma gástrico, lo que representa
el verdadero fondo del problema de salud en la infección
crónica por H pylori. En México el carcinoma gástrico
se reporta como segunda neoplasia del aparato digestivo, con una
mortalidad de 4.5 X 100,000 habitantes en el año de 1980,
cifra que aumentó a 6.5 X 100,000 habitantes en la última
década del siglo XX, situación que ha sido más
evidente en hombres, y aún cuando este incremento pueda
deberse a una mejoría en los sistemas de registro y de
obtención de información, lo preocupante es de que
a diferencia de otros países, el carcinoma gástrico
en México no ha disminuido, sino que existe francas tendencias
de aumentar, de que las mortalidades por dicha patología
cambian con la edad, es decir de < 1 X 100,000 por debajo de
los 30 años, de 1 a 10 X 100,000 para las edades de 50
a 60 años, para acercarse a 100 X 100,000 habitantes en
la población de más de 70 años, correspondiendo
a grupos que han tenido casi el 90 % de posibilidades de haber
estado infectados por el H pylori; ademas, de que la mortalidad
ha aumentado principalmente en los pacientes colocados entre los
20 y 30 años de edad ( 124 ); con la preocupación
agregada de que existen tendencias a que en México se presente
el carcinoma gástrico con más frecuencia en población
joven, con una representación hasta del 16 % del total
de carcinomas gástricos atendidos en un instituto del sector
salud nacional, informándose la incidencia más alta
a nivel mundial para el grupo etario de menores de 40 años,
con un aumento significativo de mortalidades en los pacientes
jóvenes ( 124 ). En el año 2005 Javier Torres realizó
el análisis de los 32 estados de la República, de
acuerdo a las tasas de mortalidad por adenocarcinoma gástrico,
reportando que los cuatro estados con las tasas de mortalidades
más baja ( < 4.0 ), se localizaron en el centro y en
el sur del país, teniendo la más alta seroprevalencia
de H pylori ( 70 % ); y los ocho estados con las tasas más
altas de mortalidad ( > 6.0 ) se localizaron en el norte, centro
y sur de la República con una seroprevalencia de 66 %.
Pero lo preocupante, es de que no obstante a la franca ventaja
de las condiciones socioeconómicas y de salud ambiental
para los estados del norte de la república, a la fecha
no se ha demostrado que exista una clara regionalización
de las tasas de mortalidad por carcinoma gástrico en México
( 125 ). Por lo mencionado, es prudente intentar conocer los factores
etiopatogénicos que han propiciado que el adenocarcinoma
gástrico aumente en frecuencia en México, y de tratar
de establecer cuanto interviene la infección por el H pylori
y cuanto los otros factores que tradicionalmente se mencionan
como son las dietas ( dietas altas en sal y bajas en antioxidantes
) y factores ambientales. En México, desde que aparecieron
los fibroscopios flexibles, los esfuerzos se han orientado a lograr
diagnósticos tempranos del carcinoma gástrico, situación
que no se ha logrado por haberse alcanzado sólo cifras
que no pasan del 10 % de carcinomas tempranos. Ante la evidencia
de que en México el factor etiopatogénco principal
sea la infección por H Pylori y por cepas cagA + los esfuerzos
deberán orientarse a intentar medidas preventivas para
la población en general y medidas de erradicación
de la bacteria para grupos perfectamente definidos. El panorama
al parecer no ha cambiado, como lo anticipó Tanimoto Weki
desde 1995 ( 126 ), que advirtió que México como
país en desarrollo y altas prevalencias de infección
por H pylori, la predisposición de los infectados por años,
a desarrollar adenocarcinoma gástrico debería considerarse
como un problema de salud. Esto fue confirmado desués en
la revisión del primer trabajo y último relacionado
a conocer la relación entre la infección por H pylori
y el cáncer gástrico en México, como un reto
para la prevención y el control poblacional realizado en
1997 por López Castillo ; el valor del informe, es de haber
sido multiinstitucional, recopilándose 109 pacientes con
cáncer gástrico y 177 controles hospitalarios, encontrándose
que la infección por H pylori se encontró en el
87.2 % de los casos y en el 85.5 % de los controles, que permitió
evaluar y confirmar la asociación de la presencia de la
infección por H pylori y la incidencia del cáncer
gástrico; logrando además, interpretar el riesgo
y conocer el porcentaje de casos de cáncer gástrico,
que se evitarían si se lograra la erradicación de
la infección en todo el país; con la relación
de los casos anuales reportados al Registro Nacional de Cáncer,
obtener una estimación muy relista, del número de
casos potencialmente evitables; en base a los resultados se informó
que con la erradicación de la infección por H pylori
en la población general, la incidencia de cáncer
gástrico se reduciría en un 26.6 % ( 127 ). Pero
el problema real es de que aún cuando se acepte que la
prevalencia de infección por H pylori tiende a descender,
el carcinoma gástrico tiende a aumentar, por lo que pudiera
ser necesario realizar nuevos estudios de extensión multiinstitucionales
y en toda la república, para actualizar el problema y dar
soluciones, que deben centrarse principalmente en dos caminos:
en mejorar las condiciones de salud ambiental y en el recurso
de agua potable.
Desde que se conoció el papel etiopatogénico del
H pylori en la úlcera péptica con los tratamientos
de erradicación, se logró una disminución
importantísima del problema de las recidivas de la enfermedad
ulcerosa, hecho que también se apreció en México,
y a partir de los trabajos del siglo XXI, es frecuente que se
mencione una tendencia a la disminución de las prevalencias
de infección por H pylori, en relación ha que se
han mejorado las condiciones de salud ambiental, pero sin que
se aporten evidencias sólidas, de que faltan nuevos estudios
de prevalencia que sustituyan a los clásicos de la literatura
nacional, para conocer si efectivamente han cambiado las condiciones
ambientales que favorecen la infección y que si efectivamente
se han mejorado, seguir por ese camino.
La prevención del adenocarcinoma gástrico mediante
tratamientos de erradicación de infección por H
pylori ha sido considerado en varios países, pero ante
la persistencia de interrogantes no contestadas como han sido
las tasas de reactivación de las infecciones y las tasas
de reinfección para diferentes poblaciones incluyendo a
México, al aceptarse que alrededor de la mitad de la población
mundial está infectada, en la mayoría de los países
un programa de erradicación generalizado sería impracticables
por costos y por riesgos, sobre todo en países en desarrollo,
en donde se ha conocido que por el uso indiscriminado de antibióticos,
que se adquieren sin control, se ha propiciado la emergencia de
cepas resistentes ( 128 ). Pero en algunos países de altas
prevalencias de adenocarcinoma gástrico si se ha intentado
evaluar el efecto de la erradicación del H pylori en pacientes
infectados asintomáticos con comprobación positiva
de dos estudios: prueba de aliento y por histopatología
en poblaciones de alto riesgo, y como ejemplo el estudio clásico
efectuado en la población de Fujian en China, que representa
una area de alta mortalidad estandarizada por carcinoma gástrico
de 153 X 100,000 habitantes; fueron seleccionados al azar para
recibir tratamiento con omeprazol, amoxicilina clavulanato de
potasio y metronidazol por quince días ( N0 = 817 ) y placebo
( N0 = 813 ); fueron controlados cada seis meses, a los dos años
se les efectuó prueba de aliento de control, y a los cinco
años una segunda endoscopia ; el análisis de resultados
se llevó a cabo por intención de tratar con corte
a los 7.5 años, detectando 7 casos de adenocarcinoma en
el grupo de tratamiento y 11 en el de placebo sin significación;
lo que si se mostró como efectividad del tratamiento y
con significancia estadística, fue al estudiar pacientes
libres de lesiones preneoplásicas, encontrándose
reducción del desarrollo de adenocarcinoma en los que recibieron
tratamiento de 0 casos vs. 6 de placebo ( P = .02 ) ( 129 ). Este
tipo de estudios son difíciles de realizar por lo costoso
de la metodología que incluye 3260 endoscopias, pruebas
de aliento, estudios histopatológicos, tratamientos, personal
y tiempo en años para la investigación, por lo que
en la información de los expertos en revisar evidencias
actualizadas sobre la prevención de carcinoma gástrico,
actualmente no se tienen respuestas sólidas para apoyar
campañas de erradicación generalizadas. Lo que podría
ser factible que acompañando a las campañas de salud
ambiental general y mejorando el nivel de vida, se establezcan
otros caminos de quimioprevención, como se está
llevando a cabo países con altas incidencias de carcinoma
gástrico como en el oriente asíatico ( China y Japón
) con tasas de más de 40 X 100,000 habitantes, en donde
se están reportando reducciones significativas en la mortalidad
con la campaña de agregar beta caroteno, vitamina E y selenio
a la dieta ( 130 ). También en países en desarrollo
como Colombia se ha reportado que el tratamiento con antioxidantes
junto a esquemas de erradicación con antibióticos,
si interfieren en el proceso de casrcinogénesis, mediante
la regresión de lesiones preneoplásicas: gastritis
atrófica, atrofia gástrica, metaplasia intestinal
y displasia; en Venezuela ya se está utilizando la vacunación
a nivel poblacional con mejores resultados comparados con los
tratamientos convencionales de erradicación ( 130 ).
Si al H pylori se le asocia a adenocarcinoma gástrico,
es urgente atender el problema, con la prioridad con que se han
atendido las preocupaciones de otras neoplasias en México,
ya que de acuerdo con la Organización Mundial de la Salud,
el cáncer representa una de las principales causas de muerte
de todo el mundo; de los 58 millones de muertes que se registraron
en el mundo en 2005, 7.6 millones ( 13 % ) se debiereon al cáncer,
de las cuales el adenocarcionoma de estómago ocupó
el segundo lugar con casi 1 millón de muertes. Mientras
se logra una vacuna, las proposiciones se han dado, han quedando
perfectamente delineadas, pero la realidad es que faltan los programas
de aplicación directa y los que más se mencionan
han sido los siguientes:
-
Implementar programas de sensibilización
de la comunidad médica, para que sea considerada a la
infección por H pylori como un problema de salud nacional,
para apoyar el trabajo y los diagnósticos individuales
de todos los médicos, sobre todo el de los de primer
nivel de atención y no solo de los especialistas.
-
Hacer un cambio en los objetivos de las
investigaciones científicas en México sobre el
H pylori, que se han centrado en el conocimiento de la bacteria,
del diagnóstico y de los tratamientos de erradicación,
para dirigirse más a las medidas sanitarias y evitar
su propagación.
-
Investigar el como es que la bacteria puede
también contaminar y sobrevivir en las redes de agua
potable que han sido tratadas por los procesos de potabilización
actuales, considerando el hecho sorpresivo derivado de los estudios
de evaluación bacteriológica del agua, efectuados
por el Instituto de Ecología y de la Facultad de Medicina
de la U.N.A.M., que mostraron la presencia del H pylori en todos
los sistemas de agua investigados: los de aguas residuales,
de riego y lo preocupante en los sistemas de agua para consumo
humano ( el H Pylori como otros patógenos: Legionella,
virus de la hepatitis A y E, rotavirus, adenovirus, Coxachievirus,
virus Norwalk, Crystosporidium, Giardia lamblia, etc. son resistentes
a los sistemas de cloración que se aplican en México
). ( 131, 132 )
-
Aplicar las medidas sanitarias adecuadas
para lograr la erradicación de la bacteria de los sistemas
de agua potable extra e intradomiciliarios, ejecutando las obras
necesarias para la reparación de los sistemas de alcantarillado
y de agua potable tan deteriorados y por todos conocidos ( se
habla del coctel de heces, bacterias y virus de la supuesta
agua potable de la ciudad de México, a la que se debe
agregar el H pylori ) ( 133 ).
-
La posibilidad de modificaciones de la Norma
Oficial Mexicana NOM-127-SSA1-1994, para que se considere la
obligatoriedad de establecer que el H pylori está ausente
y considerar que las muestras analizadas, permitan certificar
que las fuentes para consumo, efectivamente son potables.
-
Investigar otros sistemas de potabilización
de agua y adecuados para la destrucción del H pylori,
aplicando las modificaciones necesarias a los procesos de eliminación
de bacterias ya probados.
-
Extender los programas de agua limpia a
todas las regiones del país, sustituyendo los dispositivos
primitivos de potabilización de agua a base hipoclorito
de sodio, agregando el necesario que las investigaciones indiquen
efectividad para la eliminación del H pylori.
-
Sistemas de control de las grandes empresas
surtidoras de agua potable a domicilio, para que se asegure
de que su producto está libre de la bacteria. En México
en el 2007, existen más de 350 empresas dedicadas a la
fabricación y comercialización de agua para consumo
humano, de las cuales solo 100 están comprometidas al
programa de “ Agua Purificada Calidad Certificada “,
lo que implica el que 70 % no está cumpliendo con las
normas de salud para comercializar agua y hielo de calidad óptima.
Esta problema ya preocupó, sobre todo a los integrantes
de la LX Legislatura del Honorable Congreso de la Unión,
que tuvieron conocimiento de que “ en el agua que beben
los habitantes del Distrito Federal, es frecuente encontrar
Helicobacter pylori, que es una bacteria asociada con úlceras
del estómago y duodenales, así como con cáncer
gástrico en humanos , alcanzando una prevalencia de infección
por dicha bacteria hasta en un 90 % de los adultos en México”,
por lo que a la Comisión de Salud se le fué turnada
una iniciativa con proyecto de decreto, por el que se adiciona
un artículo 461 Bis-1 a la Ley General de Salud, para
sancionar a las empresas que no cumplan con las normas técnicas
sanitarias, iniciativa recibida el 24 de Abril del 2007.
-
Se necesita conocer si los sistemas de filtros
que se han utilizado , tengan que ser recomendados nuevamente
para su uso en el hogar con los dispositivos a base de cartuchos
o unidades de filtración o sistemas más rigurosos
de remoción de partículas nocivas y contaminantes
bacterianos importantes que provienen de fuentes de agua supuestamente
potables pero comprometidas ( dispositivos para el hogar de
tratamiento de agua de punto de entrada PDE/ punto de uso PDU
), que se conectan a la llave del agua, y que han sido sustituidos
por la compra de aguas embotelladas. Esto ha representado una
imposición de mercadotecnia sobre la economía
de las familias mexicanas de todos los sectores sociales, contribuyendo
al crecimiento de la demanda de agua embotellada, que ha superado
en más de un 20 % a la comercialización de los
refrescos de envase; además el consumo per cápita
de agua embotellada es de 169 litros por año, colocándose
al país como el segundo consumidor de agua comparado,
sólo detrás de Italia que registra un consumo
de 184 litros. Pero lo preocupante es de que dicha cultura consumista
tiene por base el conocerse que los estándares de calidad
bacteriológica del agua en uso en México, basados
únicamente en coliformes totales y fecales, no garantizan
que el agua sea segura para beber, agregándose los defectos
en la efectividad de la cloración y de saberse de que
las materias orgánicas ( especificamente la materia fecal
) reaccionan con el cloro, produciéndose los llamados
trihalometanos, que han sido conisiderados como sustancias carcinogénicas.
Estas situaciones han justificado la desconfianza generalizada
para beber agua de la llave. Esta desconfianza fue eliminada
en épocas pasadas, por la recomendación clásica
de hervir el agua de la llave durante 20 minutos, que sin duda
es útil, pero teniendo el inconveniente de que compuestos
orgánicos como insecticidas y herbicidas pueden concentrarse
al hervir el agua, ademas de que no se conoce el tiempo de ebullición
necesario par eliminar el H pylori, por lo que sin duda, el
método debe ser sustituido por sistemas de filtros con
garantía en relación al tiempo de uso útil
y seguridad de mantenimiento.
16.- DISCUSIÓN Y COMENTARIOS FINALES
A lo largo de la historia del hombre se conoce que aparecen, desaparecen
y reaparecen enfermedades, que en ocasiones han alterado severamente
la estructura y organización de las sociedades, contribuyendo
a cambiar el rumbo de las acciones de los pueblos: el cólera,
la sífilis, la peste, etc.como ejemplos, que se iniciaron
por males locales cambiaron a regionales y después a verdaderas
pandemias, conduciendo a la globalización tanto como problemas
de salud, como la forma de resolverlos; un ejemplo y actualizado
de lo mencionado está dado por la infección más
extendida en todo el mundo y debida al H pylori ( 134 ). Gracias
a la teorías de la transición epidemiológica,
derivada a su vez de la transición demográfica,
se ha podido entender los cambios en los patrones de salud y de
las enfermedades, como dependientes de las dinámicas demográficas,
económicas y de desarrollo de cada país y que influyen
en las características de la transición a mejores
condiciones de salud y de vida, en relación a los recursos,
con características propias en las direcciones, magnitudes
y en el tiempo ( 135 ). La teoría de la transición
epidemiológica ha descrito el tránsito de las primeras
etapas de altas mortalidades, en donde las enfermedades infecto-contagiosas
representaron la característica dominante del espectro
sanitario, y que han sido sustituidas por otra patologías
del tipo de enfermedades crónico-degenerativas como la
diabetes, la hipertensión arterial, la obesidad, las neoplasias,
los padecimientos mentales, etc. A cada era le ha correspondido
un perfil demográfico específico, por lo que el
perfil pretransicional, se acompañó de altos niveles
de mortalidades, altas fecundidades y bajas esperanzas de vida,
y ahora el perfil postransicional para los países que lo
han alcanzado, es lo contrario: tasas de mortalidades bajas, fecundidades
bajas y un aumento importante en las esperanzas de vida ( 136
). Pero es entendible que los procesos de transición demográfica
y epidemiológica de los distintos países no tienen
una cronología única, que tampoco son unidireccionales,
que son influidos por el hecho de que las patologías existentes
en una sociedad, pueden tener o no un inicio, de que no existen
certidumbres de un fin irreversible y de que tampoco existen certidumbres
de la aparición o desapareción de una enfermedad,
lo que hace posible que en un país determinado, existan
perfiles epidemiológicos diferentes tanto en sus estratos
poblacionales, como en sus diferentes regiones geográficas,
como es el caso de México ( 137 ).
Esto lleva a aceptar que la transición epidemiológica,
se efectua en modelos diferentes y calificados como tradicional
o aceptable para los países desarrollados y prolongada
o dilatada, polarizada o diferenciada para los en vías
de desarrollo, como es el caso de los países latinoamericanos
y del caribe, en donde las transiciones epidemiológicas
no han seguido el mismo camino, que se ha seguido uno con tránsito
dilatado, donde las enfermedades crónicas-degenerativas
y las infecto-contagiosas se mezclan y persitirán por largos
períodos de tiempo, y ademas, que en algunos países
como es el caso de México el modelo de transición
se ha polarizado, es decir se ha diferenciado, en donde los estratos
sociales o regiones de alto nivel socioeconómico están
o ya llegaron al término de la transición epidemiológica,
mientras que los estratos, sociales menos favorecidos, siguen
sufriendo las patologías que ya han sido controladas en
otros ambientes. ( 137, 138 )
Sin embargo la emergencia de problemas infecciosos que se están
viviendo y a nivel mundial como el caso del SIDA, las enfermedades
de transmición sexual, la hepatitis C, etc., y la imputación
de agente infecciosos para la génesis de patologías
como el caso del papiloma humano, de la Clamidia pneumoniae y
sobre todo el H pylori, nos hablan de procesos patológicos
dinámicos que ameritan atenciones permanentes, sobre todo
en México, que no ha alcanzado el calificativo de país
desarrollado, pero reconociéndose sin duda que por los
elementos aportados por la epidemiología, la eficiente
administración de los recursos económicos aplicados
a la salud y la eficiente organización de sus sistemas
de atención, se transita por el camino adecuado. Se aprecia
un rápido cambio en sus perfileas de salud, con una disminución
paulatina de los padecimientos y patologías propias del
subesarrollo y un incremento de las patologías que prevalecen
en los países industrializados. ( 138 )
En el caso de la infección por H pylori como tema que
nos ocupa, la transición epidemiológica en los países
desarrollados ha seguido el modelo adecuado, con francas tendencias
a su control y a su desaparición, demostrado por las disminuciones
importantes de sus prevalencias y la consecuente disminución
de la enfermedad ulcerosa gastroduodenal, pero lo más significativo,
lo representa la disminución importante de los casos de
carcinoma gástrico y de las cifras de mortalidad. ( 139
) En cambio en México dichas tendencias no se han demostrado,
se ha sugerido que la prevalencia de infección por H pylori
tiende a descender, pero en la realidad el carcinoma gástrico
si ha aumentado, por lo que este sólo hecho hace que la
infección por H pylori sea considerado como un problema
de salud, repitiendo lo que con gran visión, anticipó
Tanimoto Weki, y de que el modelo de transición epidemiológica,
parece ser el prolongado ( 126 ).
Esto llevaría a intentar conocer las condiciones por las
que en México se sigan manifestando prevalencias de infección
por H pylori con cifras arriba del 70 % para toda la población,
aceptar que el fenómeno demográfico explosivo de
la migración de las poblaciones del campo a las ciudades
y que era del 42 % para 1950, pasó a ser de 74 % o más
a partir de 1990, convirtiendo a las grandes ciudades en escenarios
adecuados para la transmición de la infección: estratificaciones
socio-económicas, habitaciones insalubres, hacinamientos,
limitaciones de recursos para el cuidado de la salud y lo más
significativo, el problema del agua potable para el consumo. (
132 )
Esto ha condicionado que el problema de la infección
por H pylori en México, se salga de los manejos de las
infecciones agudas del tracto digestivo, en donde el médico
general de primer contacto o el médico familiar, lo resuelven
en el primer nivel de atención, e incluso con las limitaciones
por todos conocidos, se podría aceptar que el costo del
tratamiento de una diarrea aguda es aceptable ( la importancia
del programa de la hidratación oral ), pero en el caso
de la infección por H pylori, que representa una infección
crónica, las atenciones que se han dado en México
y hasta la fecha, han sido privilegiadas, con el concurso de médicos
de segundo y de tercer niveles de atención, atenciones
que han dependido de la tecnología, de esquemas de erradicación
con tres o cuatro fármacos, con seguimientos en todas las
instituciones de atención del sector salud nacional y con
costos elevados.
El desafió estará en adaptarse a un proceso dinámico
derivado de acciones concretas y accesibles como pueden ser:
-
Continuar e incluso incrementar el papel
preventivo: agua potable universal, habitación humana
y social adecuada y llegar a la vacunación profilactica
en infantes y terapéutica para adultos.
-
Modificaciones a la norma que establece
los requisitos de agua potable para que sea incluida la investigación
no solo de colibacilos y parasitosis, sino que quede incluida
la investigación de la presencia de H Pylori y de otros
patógenos.
-
Orientar los recursos de cobertura para
el diagnóstico en grupos poblacionales, sobre los que
pueda caer el mayor peso de posibilidades de infección
y sobre todo por cepas de alta virulencia.
-
Identificación de los pacientes sintomáticos
y para los de 40 años o más, establecer la conducta
de investigar, probar y tratar con esquemas terapeúticos
de erradicación, actualizados y accesibles.
-
La única manera de diagnosticar infección
presente y erradicación en su caso del H pylori, es por
prueba positiva de aliento o de aire espirado y por la identificación
de antígenos fecales del H pylori, por lo que se deberán
establecer los recursos y los procedimientos para que estas
pruebas no invasivas, se coloquen al alcance de los médicos
de primer nivel de atención y no sólo para investigaciones
clínicas y en el ejercicio de la medicina para los estratos
sociales privilegiados, que probablemente sean los menos infectados.
-
Lograr mayor interés en investigaciones
sobre los padecimientos extradigestivos, que integran la lista
y que se han relacionado a la infección por H pylori,
la que estando circunscrita a la mucosa gástrica, existen
las posibilidades de que se produzcan lesiones a distancia,
por alteraciones en los niveles de mediadores sistémicos
de la inflamación, con trabajos relacionados a las cepas
bacterianas y sobre todo a las respuestas inmunes de los hospederos
susceptibles a dichas patologías.
-
Lograr una vacuna
-
Conformarse con haber controlado a satisfación
enfermedades infecciosas agudas, y apegarse a normas de calidad
insuficiente, puede dañar gravemente la salud de los
habitantes, ya que el cáncer y otras enfermedades crónicas
son irreversibles.
-
De otra manera, el papel de observadores
pasivos, eso sí con mucha paciencia, para tener la suerte
de que la infección por H pylori, tenga una eliminación
espontanea, no representa el camino adecuado para México,
ya que se tienen los recursos y sobre todo la capacidad de sus
médicos.
17.- GLOSARIO Y DEFINICIONES
ADENOCARCINOMA.- Proceso tumoral ocasionado por células
patológicas que tienen la capacidad de diseminarse, invadir
y destruir tejidos; en el caso del estómago por costumbre
se le denomina carcinoma y ocupa el 95 % o más de las neoplasias
gástricas.
ANTICUERPO: Molécula glucoproteíca, conocida como
inmunoglobulina, producida por los linfocitos B, con la capacidad
de unirse a antígenos con un alto grado de especificidad
y de afinidad.
ANTÍGENO.- Macromoléculas conocidas como inmunógenos
que tienen la capacidad de desencadenar respuestas inmunes, y
de unirse a anticuerpos específicos o a receptores de linfocitos.
APOPTOSIS.- Conocida como muerte celular programada, asociada
a la destrucción del ADN y que no se asocia a respuesta
inflamatoria tisular.
CASPASAS.- Proteasas que tiene por función fragmentar residuos
del ácido aspártico que actuan como mensajeros intracelulares
en la apoptosis.
CITOCINAS.- Proteinas sintetizadas por diferentes tipos celulares
que intervienen en las reacciones inflamatorias e inmunitarias,
actuando como mediadores de comunicación entre las células
del sistema inmunitario.
GASTRITIS CRÓNICA.- Representa una inflamación de
la mucosa gástrica, que se presenta gradualmente y por
tiempo prolongado, implicando atrofia de grado variable, con la
pérdida progresiva de la capacidad funcional de la mucosa,
que se puede acompañar de metaplasia y de displasia de
grados variables.
INFECCIÓN POR H pylori.- Esta bacteia es responsable de
la mayoría de las úlceras pépticas, de las
gastritis crónicas y de representar un elemento carcinogenético
tipo I y asociarse a tumores de estirpe linfoide del estómago.
Teniendo una distribución mundial, no se le considera un
microbiota habitual, por el hecho de que su presencia siempre
produce una respuesta inflamatoria e inmunitaria de grado variable,
con o sin sintomatología.
LINFOMA MALT.- Es un linfoma no Hodgkin de células B, extranodal
considerado dentro del grupo de lo linfomas de la zona marginal
( junto a los linfomas B esplénico y linfoma ganglionar
de la zona marginal ).
RESPUESTA ADAPTATIVA.- Mecanismos celulares y humorales ( mediadores
) estimulados por la exposición a agentes infecciosos y
que se incrementan cuantitativamente, y con capacidad de defensa
ante una primera exposición, o sucesivas de agentes infecciosos.
RESPUESTA INNATA.- Mecanismos de defensa de tipo bioquímico
o celular presente incluso antes de que se inicie un proceso infeccioso,
representando una defensa de acción rápida.
RESPUESTA Th0.- Implica una respuesta inmune indiferenciada, que
de acuerdo al tipo de citocinas presentes en el medio, desencadena
una respuesta diferenciada de tipo Th1 si se expresan citocinas
como IFN-y, o bien una respuesta de tipo Th2 si las citocinas
actuantes son del tipo IL-4 e IL-5.
RESPUESTA Th1.- Respuesta inmune de tipo adaptativa mediada por
linfocitos T cooperadores que producen principalmente IFN-y, estimulando
las defensas por acción de los fagocitos, especialmente
en caso de infecciones por agentes intracelulares.
RESPUESTA Th2.- Respuesta inmune de tipo adaptativa mediada por
linfocitos T cooperadores que producen interleucinas IL-4 e IL-5,
con funciones de estimular las reacciones inmunitarias mediadas
por anticuerpos, eosinófilos y mastocitos, amortiguando
ademas la respuesta Th1.
RESPUESTA Th3.- Respuesta mediada por linfocitos T que regulan
la actividad de otros linfocitos T, para mantener la tolerancia
periférica a los antígenos propios.
SISTEMA INMUNITARIO DE LAS MUCOSAS.- Sistema inmunitario que participa
en la defensa de los epitelios que cubren las capas mucosa y submucosa
de los aparatos y sistemas del organismo, no sólo frente
a organismos patógenos, sino también protegiendo
de antígenos del medio ambiente y de los derivados de alimentos.
ÚLCERA.- Lesiones circunscritas que se definen en su apariencia
como parecidas a cráteres, que se presentan en la piel
o en una superficie mucosa, producidas por una condición
inflamatoria, infecciosa o maligna, dando un aspecto de pérdida
de continuidad anatómica.
ÚLCERA PÉPTICA.- Gástrica o duodenal y que
son erosiones muy localizadas por destrucción de la mucosa.
VacA ( toxina vaculoizante ).- Es un factor de virulencia producida
por el H pylori, que ocasiona vaculozación citoplasmática
en los cultivos celulares y muerte de las células epiteliales,
con la estimulación de la migración de neutrófilos
a la mucosa infectada por la bacteria.
CagA ( toxina A ).- Proteina codificada por el gen cagA del H
pylori, con características de ser un antígeno de
gran capacidad inmunogénica, que desencadena la activación
de interleucina IL-8 y de FNT ( factor de necrosis tumoral ),
infiltración de neutrófilos y la inducción
de la respuesta inflamatoria ( 41 ).
18.- BIBLIOGRAFÍA
-
Reyes HS
Helicobacter pylori: La bacteria que nadie soñó
Departamento de Química y Biología. Universidad
de las Américas, Puebla
http://hosting.udlap.mx/profesores7miguela.mendez/alephozero/archivo/historico/az/41/medicina2005.html
-
Marshall BJ
Unidentified curved bacilli on gastric epithelium in active
chronic gastritis ( letter )
Lancet 1983; 1: 1273 – 75
-
Marsall BJ, Warren JP
Unidentified curved bacilli in the stomach patients with gastritis
and peptic ulceration
Lancet 1984; 1: 1311 – 15
-
Pérez-Pérez IG
? Es la asociación de Helicobacter pylori con los humanos
un clásico ejemplo de parasitismo ¿
Rev Gastroenterol Mex 2000; 65 ( supl 2 ): 7 – 12
-
Buzas GM
History of the discovery of Helicobacter pylori
Orvostort Kozl 2004; 49 ( 3-5 ): 45 - 56
-
PajareS JM, Gisbert jp
Helicobacter pylori: its discobery and relevante for medidine
Rev Esp Enferm Dig 2006 Oct; 98 ( 10 ): 770 – 85
-
Konturek SJ, Konturek PC, Brzozowski, Konturek
JW, Pawlik WW
From nerves and hormones to bacteria in the stomach; Novel prize
for achievements in gastroenterology
Physiol Pharmacol 2005 Dec; 56 ( 4 ): 507 – 30
-
Pounder RE, NG D
The prevalence of Helicobacte pylori infection in different
countries
Aliment Pharmacol Ther 1995; 9 ( Suppl 2 ): 33 – 7
-
Morales EMR, Castillo RG, López VY,
Cravioto A
Helicobacter pylory
Laborarorio de Inmunología Molecular Microbiana
Facultad de Medicina UNAM
http://www.microbiologia.org.mx/microbiosenlinea/capitulo_15/capitulo.pdf
-
González MJE, Lelal VL, Guzmán
LS, Guzmán TGM, González MNA
Helicobacter pylori y enfermedad
Revista Alergia México 2004; 51 ( 6 ): 218 – 25
-
Marshall BJ, Amsrong J, Mcgechie D, Glancy
R
Attempt to fulfill Koch´s postulates for Campilobacter
pylori
Med J Aust 1985; 142: 436 - 39
-
Konturek JW
Discovery by Jaworski of Helicobacter oylori and its pathogenetic
role inpeptic ulcer, gastritis and cancer gastric
J Phisiol Pharmacol 2003 Dec, 54 ( Suppl 3 ) : 23 – 41
-
Morris AJ, Nicholsong T
Ingestion of Campilobacter pylori cause gastritis and raised
fasting Ph
Am J Gastroenterol 1987; 82: 192 – 99
-
Argilia CM
Helicobacter pylori y enfermedades extradigestivas
Actualidad SEM 2003; 31: 15 -8
-
Rivera M, Contreras F, Terán A, Fouillioux
C
Helicobacter pylori: Enteropatógeno frecuente del ser
humano
Arch Venezol Farmac y Terap 2004; 23 ( 2 ): 118 – 22
-
Leontiadis GI, Sharman VK, Howden CW
Non-gastrointestinal tract associations with Helicobacter pylori
infection
Arch Intern Med 1999; 159: 925 – 40
-
Pakodi F, Abdel-Salam OM, Debreceni A, Mózsik
G
Helicobacter pylori. One bacterium and a broad spectrum of human
disease! An overview
J Physiol Paris 2000 Mar-Apr; 94 ( 2 ): 139 - 52
-
Aguilar RG, Ayala G, Fierros ZG
Helicobacter pylori: Recent advances in the study of its pathogenicity
and prevention
Salud Publica Mex 2001 Mayo- Junio; 43 ( 2 ): 33 - 54
-
Ballesteros AMA
Úlcera péptica y Helicobacter pylori. Resultados
y consecuencia de su erradicación
Rev Gastroenterol Mex 2000; 65 ( Supl ): 41 – 49
-
Geofrey WB
Effect of Helicobacter pylori infection in Barrett´s esophagous
end the genesis of esophageal adenocarcinoma
World J Surg 2003 Sept; 27 ( 9 ): 994 – 8
-
Cervantes GE
Helicobacter pylori e infeciones asociadas
Rev Fac Med UNAM 2006 Julio-Agosto; 49: 163 – 68
-
Hunt RH, Xiao SD, Megraud F, Barua LG, Bazzoli
F et al
WGO-OMGE practique guideline highlights: Helicobacter pylori
in develpoping countries
http://www.org/publications/archive/2006_2/sci/sci7.htm
-
Pérez Pérez GI
Fisiopatología del Helicobacter pylori
SAM Esófago, estómago y duodeno
Sistema de actualización médica 2007 Libro 2:
39 – 44
Intersistemas, S.A de C.V. México, D. F.
-
Solnik JV, Shauer DB
Emergence of diverse Helicobacter species in the pathogenesis
of gastric and enterohepatic diseases
Clin Micribio Rev 2001; 14: 59 – 67
-
Torres J
Aspectos epidemiológicos y clínicos de la infección
por H. pylori en niños
Rev Gastroenterol Mex 2000; 65 ( Supl 2 ): 13 - 19
-
Anzures LB
Helicobacter pylori
Rev Med del Hospital General México, D.F. 2001 Oct-Dic;
64 ( 4 ): 199 – 2001
-
Ramírez MJ, Cervantes R, Mata N,
Zárate F
Enfermedad ácido péptica y Helicobacter pylori
en pediatria
Acta Pedriat Mex, 1999; 20 (1 ): 23-29
-
Torres J, Leal HY, Pérez-Pérez
g
A community-based seroepidemiological study of Helicobacter
pylori infection in México
J Infect Dis 1998; 178: 1089 – 94
-
Lagunes YB
Prevalencia de Helicobacter pylori en niños en edad escolar
Rev Mex Patol Clin 2001 Enero-Marzo; 48: 23 – 26
-
Constanza CM, Lazcano PE, Torres J, Velasco
ME, Quitero M, Correa P
Determinants of Helicobacter pylori seroprevalence in Mexican
adolescents
Helicobacter 2004; 9: 106 – 14
-
Rodríguez CR, Alcántara LJJ,
Lagunes YB, Rivera DME, Calva CD, Santos ME
Prevalencia del Helicobacter pylori en tres poblaciones de niños,
de la ciudad de Puebla, México, y sus factores de riesgo
Rev Gastroenterol Mex 2006; 71 ( 4 ): 440 – 5
-
Goodman KJ, O´Rouikek K, Dy RS, Wang
C, Redlinger T, Campos A, de la Rosa JM
Helicobacter pylori infection in pregnanT women from a U.S.-
México border population
J of Immigrant Health 2003 July; 5 ( 3 ): 99 – 107
-
Mohar A, Ley C, Guarner J, Herrera-Goepfert
R, Sánchez
Alta frecuencia de lesiones precursoras de cáncer gástrico
asociado a Helicobacter pylori y respuesta al tratamiento en
Chiapas, México
Gac Med Mex 2002; 138: 405 – 10
-
Martin K, Rodin S, Kupersmith I, Lundin
A, Tindberg YI, Granström M
Helicobacter pylori genome variability in a framework of familial
transmission
BMC Microbiology 2007; 7: 54 – 66
-
Boneca IG, de Reuse H, Epinat JC, Pupin
M, Labigne A, Moszer I
A revised annotation and comparative analysis of Helicobacter
pylori genomas
Nucleic Acid Research 2003; 31 ( 6 ): 1704 - 14
-
Forné B
Diagnóstico de la infección por Helicobacter pylori
y tratamiento de de la infección en pacientes con úlcera
duodenal
Tésis Doctoral. Capítulo: Aspectos microbiológicos
del Helicobacter pylori, pags 12 – 17
Barcelona, España, 2001
-
Blaser MJ, Atherton JC
Helicobacter pylori persistence: biology and disease
J Clin Invest 2004 February 1; 113 ( 3 ): 321 – 33
-
Kuster JG, van Vliet AHM, Kuipers EJ
Pathogenesis of Helicobacter pylory
Clinical Microbiology Reviews 2006 July; 19 ( 3 ): 449 –
90
-
Aras RA, Kang J, Tschumi A, Blazer MJ
Extensive repetitive DNA facilitate prokaryotic genome plasticity
Proc Natl Acad Sci U.S.A. 2003; 100: 15056 – 61
-
Xu Q, Morgan RD, Roberst RJ, Blazer MJ
Identification of type II restriction and modification systems
in Helicobacter pylori reveals their substantial diversity among
strains
Proc Natl Acad Sci U.S.A. 2000; 97: 9671 – 6
-
Marcano LMJ, Infante BF, Rangel C, Rojas
MA
Theoretical model of immune response in Helicobacter pylori
gastric mucosa infection
Bioline International 2006; 26 ( Enero – Marzo )
http://www.bioline.org.br/request?va06005
-
Delgado I, Alonso LO, Hernández-Guerrero
A, Sobrino CS, Herrrera-Goefner R, Rosales SA, Martínez
F
Linfoma gástrico primario tipo MALT ( MALTOMAS )
Rev Gastroenterol Mex 2002; 67 ( Supl 3 ): 162
-
Blaser MJ, Berg DE
Helicobacter pylori genetic diversity and risk of human disease
J Clin Invest 2001; 107: 767 – 73
-
Parsonnet J
Helicobacter pylori
Infect Dis Clin North Am 1998 ; 12 ( 1 ) : 185 – 97
-
Rivas TF, Fernández F
Helicobacter pylori: Factores de virulencia, patología
y diagnóstico
Rev Biomed 2000; 11: 187 – 205
-
Fochesatto NA, Guayan VA, Moran ELE
Helicobacter pilori y enfermedad gastroduodenal. Bases para
el diagnóstico y el tratamiento. Facultad de Medicina
UNNE, Corrientes, Argentina
Revista de postgrado de la VIa Cátedra de Medicina 2004;
138: 11 – 17
-
Nomura AMY, Pérez-Pérez GI,
LeeJ, Stemmerman MJ, Blaser MJ
Relationship between H. pylori cagA status and risk of peptic
ulcer disease
Am J Epidemiol 2002; 155: 1054 – 9
-
Blaser MJ
Infection with Helicobacter pylori strains possessing cagA associated
with an increased risk of developen adenocarcinoma of the stomach
Cancer Res 1995; 55: 2111 – 15
-
Garza-González E, Pérez-Pérez
GI, Tijerina MR, Maldonado GHJ, Bosques PFJ
Genotipos de Helicobacter y su asociación con la respuesta
inmune del hospedero
Rev Gastroenterol Mex 2002; 67 ( 3 ): 155 – 60
-
Pérez-Pérez GI, Peek RM, Legath
AJ, Heine PR, Graaff LB
The role of cagA status in gástric and extragastric complications
of Helicobacter pylori
J Physiol Pharmacol 1999: 50: 833 - 45
-
Nogueira RR, Jiménez GA, Cervantes
SC
La infección gástrica por Helicobacter pylori
es un factor de protección para la enfermedad por reflujo
gastroesofágico
Rev Gastroenterol Mex 2002; 67: 22 – 7
-
Carmona SR, Navarro CG
La prevalencia de infeción por Helicobacter pylori en
paciente con esofagitis por reflujo. Estudio de casos y controles
Rev Gastroenterol Mex 2003; 68 ( 1 ): 25 – 28
-
Sharma P, Vakil N
Review article: Helicobacter pylori and reflux disease
Aliment Pharmacol Ther 2003; 17: 297 – 305
-
Koike T
Helicobacter pylori infection prevents erosive reflux oesophagitis
by decresing gastric acid secrtetion
Gut 2001; 49: 330 – 4
-
Ott EA, Mazzoleni LE, Edelweis MI
Helicobacter pylori eradication does not cause reflux oesophagitis
in functional dyspeptic patients: a randomized, investigator
blinded, placebo controlled trial
Aliment Pharmacol Ther 2005; 21: 1231 - 9
-
Fox JG
Concurrent enteric helminth infection modulates inflammation
and gastric inmune responses and reduce helicobacter-induced
gastric atrophy
Nat Med 2000; 6: 536 – 42
-
Bouquet p
Gastric cell apoptosis and Helicobacter pylori: has the main
function of VacA finally been identified
Trends of Microbiology 2003; 11 ( 9 ): 410 – 3
-
Arenillas P, Godoy A, Einisman H, Garcia
D, Harris P
Regulación de la respuesta inmune frente a la infección
por Helicobacter pylori
Revista Chilena de Pediatría 2002; 73 ( 2 ): 108 –
15
-
Egan BJ, O´Morain CA
A historical perspectiva of Helicobacter pylori gastroduodenitis
and its complications
Best Pract Res Gastroenterol 2007; 21 ( 2 ): 335 – 46
-
Dehesa VM, Robles DG
Consenso Mexicano sobre Helicobacter pylori
Rev Gastroenterol Mex 1997; 62: ( 1 ): 41 - 5
-
Tytgat Guido NJ
Helicobacter Pylori associated duodenal ulcer disease
Rev Gastroenterol Mex 2003; 68 ( Supl 3 ): 56 - 58
-
Hatz R, Schildberg FW
Helicobacter pylori infections-are these diseases relevant for
surgical treatment ?
Langenbechs Arch Surg 2000; 385 ( 2 ): 75 - 83
-
Hassan SR, Abbas Z
Presence of Helicobacter pylori in dyspeptic patients with endoscopicaly
normal stomach
Pak J Med Sci 2007; 23 ( 3 ): 335 – 9
-
Moayyedi P, Soo S, Deeks J, Delaney B, Harris
A, Innes m
Eradication of Helicobacyter pylori for non ulcer dispepsia
Cochrane Database System Rev 2006; ( 2 )CD002096
-
Malfertheiner P, Megraud F, O´Morain
C, Bassoli F, El-Omar E, Graham D
Current concepts in the management of Helicobacter pylori infection:
the Maastrich III Consensus Report
Gut 2007; 56: 772 – 81
-
Ladrón de Guevara L, Gómez-Peña
AN, Padilla L, Lichtinger A, Figueroa S, Shapiro I, Rubinstein
M, Di Silvio M
Evaluación de la sintomatología y calidad de vida
en la dispepsia funcional antes y despues del tratamiento de
erradicación de Helicobacter pylori
Rev Gastroenterol Mex 2004; 69 ( 4 ): 201 – 8
-
Carmona SR
Erradicación de Helicobacter pylori en dispepsia no ulcerosa
Rev Gastroenterol Mex 2004; 69 ( 4 ): 288 – 9
-
Domínguez MN, Alva RA, Arámbula
ChM, Castañon SC, Rodríguez HH
Incidencia en la gastropatía por AINE´s y su asociación
con Helicobacter pylori
Rev Gastroenterol Mex 1999; 64 ( Núm especial de Dic
): 68 Cartel 6
-
Ballesteros AMA
Helicobacter pylori y hemorragia por úlcera péptica
Rev Gastroenterol Mex 2003; 68 ( Supl 3 ): 60 – 62
-
Zárate GA
Helicobacter pylori y antiinflamatorios no esteroideos
Rev Gastroenterol Mex 2007; 72 ( Supl 1 ): 37 -38
-
Correa P, Haenzel W, Coello C
Gastric precancerous process in a high risk population: Cross
seccional studies
Cancer Res 1990; 50: 4731 – 4
-
de La Torre BA
Neoplasias gástricas
Rev Gastroenterol Mex 2003; 68 ( Supl 3 ): 66 – 67
-
Parkin DM
The global health burden on infection-associated cancer in the
year 2002
Int J Cancer 2006; 118: 3030 – 40
-
Parsonnet J, Friedman GD, Orentreich N
Risk for gastric cancer in people with CagA positive or CagA
negative Helicobacter pylori infection
Gut 1997; 107: 297 – 301
-
Peura DA
Helicobacter pylori: Scientific basis to patients cure
Rev Gastroenterol Mex 2006; 71 ( Supl 1 ): 31 – 3
-
Pineda CBE
Helicobacter pylori y cancer
Rev Gastroenterol Mex 2007; 72 ( Supl 1 ): 35 – 6
-
Dehesa VM
infección por Helicobacter pylori ¿ Que nos depara
el futuro ¿
Curso precongreso: La Gastroenterología al final del
milenio
Rev Gastroenterol Mex 1999; 64 ( Núm especial de Dic
): 30 – 33
-
Guarner J, Mohar A
La asociación entre Helicobacter pylori y neoplasias
gástricas. Evidencia epidemiológica
Rev Gastroenterol Mex 2000, 65 ( Supl 2 ): 20 – 24
-
Wotherspoon AC, Ortíz HC, Falzon
MR, I saacson PG
Helicobacter pylori-associated gastritis and primary B-cell
gastric limphoma
Lancet 1991; 338: 1175 - 6
-
Parssonet J, Hansen s, Rodríguez
L, Gelb AB, Warnke RA, Jellum E, et al
Helicobacter pylori infection and gastric limphoma
N Engl J Med 1994; 330: 1267 – 71
-
Tytgat Guido NJ
Gastric MALT-Lymphoma
Rev Gastroenterol Mex 2003; 68 ( Supl 3 ): 73 – 75
-
Piña OS, Ortíz HC
Linfoma de células B de la zona marginal extraganglionar
de tejido linfoide asociado a mucosas ( linfoma MALT ). Evolución
histórica y conceptos actuales
Gac Med Mex 2007; 143 ( 3 ): 237 – 44
-
Malfertheiner P, Megraud F, O´Morain
C, Bazzoli F, El-omar E, Graham D et al
Current concepts in the management of Helicobacter pylori infection:
The Maastricht III Consensus Report
Gut 2006; 56: 772 – 81
-
Azuma T
Gastric leptin and Helicobacter pylori infection
Gut 2001; 49: 324 – 9
-
NwokoloCU, Freshwater DA, O´Hare P,
Randeva HS
Plasma ghrelin following cure of Helicobacter pylori
Gut 2003; 52: 637 – 40
-
Méndez SN, Chávez NC, Uribe
TM
La ghrelina y su importancia con el eje gastrohipotalámico
Gac Med Méx 2006;142 ( 1 ): 49: 58
-
Ramírez MJ, Chanis R, Cervantes R,
Cuevas F
Gastritis crónica asociada a Helicobacter pilori
Acta Pediatr Mex 1993;14: 119 – 21
-
Heller RS
Helicobacter pylori en población pediátrica
Rev Gastroenterol Mex 2007; 71 ( Supl 1 ): 39 – 41
-
Bernal RR
Helicobacte pylori, métodos de diagnóstico
SAM Esófago, estómago y duodeno
Sistema de Actualización médica 2007 Libro 2:
39 - 44
Intersistemas, S.A. de C.V. México, D. F.
-
Díaz GF,
Aspecto endoscópico de la mucosa gástrica en pacientes
con infección por Helicobacter pilori
Rev Gastroenterol Mex 2002; 67 ( Supl 3 ): 154
-
Aguilar SO, Majalca MC, León FE,
Avila VG, Sánchez MR, Figueroa BSA, et al
Estudio comparativo entre las pruebas de ureasa rápida,
la impronta y el estudio histopatológico para el diagnóstico
de Helicobacter pylori
Rev Gastroenterol Mex 2004; 69 ( 3 ): 136 – 42
-
Chirino R, Cabrera M, Villacorta C, Blancas
J, Torres J, Moran S, Dehesa M
Evaluación topográfica y grado de daño
de la mucosa gástrica en pacientes con diferentes enfermedades
gastroduodenales e infección por Helicobacter pilori
Rev Gastroenterol Mex 1999; 64 ( Núm especial ): 76 Trabajo
libre 37
-
Merin LA, Medina ML, Medina MG
Consideraciones actuales por la presencia de Helicobacter pylori
en cavidad bucal
Facultad de Medicina. Universidad Nacional del Nordeste. Corrientes.
Corrientes
lamerino@bib.unne.edu.ar
-
Gómez MJ, Garrido SG, Cordero HH,
Arana PG, Reyes DA
Detección del Helicobacter pylori mediante tinción
de una impronata de mucosa gástrica con azul de metileno
Rev Gastroenterol Mex 1999; 64 ( Número especial ): 47
-
Arista-Nazae J
Gastropatías, gastritis, gastritis aguda y crónica
y úlcera péptica
Rev Gastroenterol Mex 2005; 70 ( Supl ): 21 – 23
-
Martínez MF, Ortíz HC, Torres
V, Álvarez L, Manzo MA, Garcia LL
Cambios regenerativos atípicos y carcinoma in situ en
gastritis crónica asociada con Helicobacter pylori
Rev Gastroenterol Mex 2000; 65 ( 1 ): 11 - 7
-
Trujillo CJ, Hernández GA, Podolsky
RI, Campillo OV, Ibarra RM, Herera GR
Utilidad de la citología gástrica por cepillado
para el diagnóstico de Helicobacter pylori
Rev Gastroenterol Mex 1997; 62 ( 4 ) ( Supl 1 ): 39
-
Gómez AN, Álvarez LR, Zapatier
AJ, Vargas EP
Eficacia de las pruebas de antígenos en heces y serología
para el diagnóstico de Helicobacter pylori en la población
ecuatoriana
Rev Gastroenterol Mex 2005; 70 ( 2 ): 146 - 9
-
Vaira D, Vakil N, Menegatti Van Hohh B
The stool antigen test for detection of Helicobacter pylori
after eradication therapy
Ann Int Med 2002; 136: 280 – 3
-
Fallone CA, Elizov M, Cleland p
Detection of Helicobacter pylori infection by saliva IgG testing
Am J Gastroenterol 1996; 91: 1145 – 8
-
Okuda M, Nakazawa T, Booka M, Miyashiro
E, Yosikawa N
Evaluation of a urine antibody test for Helicobacer pylori in
japanese children
J Pediatr 2004; 144: 196 – 8
-
Premoli G, González A, Milán-Mendoza
B, Peroco T, Vielma A
Diagnóstico de Helicobacter pylori mediante la reacción
de cadena de la polimerasa
Rev Cubana Med 2004; 56 ( 2 ): 85 - 90
-
Blancas VJM
La importancia del diagnóstico del Helicobacter pylori
Rev Gastroenterol Mex 2004; 69 ( 3 ): 186 – 7 Editorial
-
Dehesa VM
Tratamiento de la infección por Helicobacter pylori ?
A quién tratar y con qué ¿
Rev Gastroenterol Mex 2000; 65 ( Supl 2 ): 55
-
Dehesa VM, Robles DG, Aguirre GJ, Arista
NJ, Ballesteros AMA et al
Consenso Mexicano de Helicobacter pylori
Rev Gastroenterol Mex 1997; 62 ( 1 ): 41 - 5
-
Rodríguez HH, Sánchez ALF,
Quiñones E
Erradicación del Helicobacter pylori en úlcera
péptica y gastritis crónica. Ensayo clínico
aleatorio
Rev Gastroenterol Mex 1998; 63 ( 1 ): 21 – 7
-
Dehesa VM, Larisch J, Dibildox M, Vega B,
Di Silvio M, Rodríguez l et al
Comparación de dos esquemas basados en pantoprazol para
erradicación de Helicobacter pylori en pacientes con
úlcera duodenal activa
Rev Gastroenterol Mex 1998; 63 ( 2 ): 66 – 71
-
Pérez-Pérez G
? Cuando y por qué debemos erradiar al Helicobacter pylori
¿
Rev Gastroenterol Mex 2005; 70 ( Supl 3 ): 26 - 27
-
Malfertheiner P et al
Current European Concepts in the Management of Helicobacter
pylori infection.
The Maastricht Consensus Report 1996: 12 – 23
-
Abdo FJM, Uscanga DL et al
Actualidades en Helicobacter pylori
Consenso Mexicano 2007
Asociación Mexicana de Gastroenterología
Intersistemas, S.A. de C.V. México, D.F.
-
Cañedo-Chávez S
Tratamiento de la infección por Helicobacter pylori
Rev Gastroenterol Mex 2001; 66 8 Supl 2 ): 53 – 60
-
Alanís AO, Garza GE, Maldonado GHJ,
Tijerina MR, Bosques PFJ
Sensibilida de Helicobacter pylori a ofloxacina y levofloxacina
Rev Gastroenterol Mex 2001; 66 ( Supl 2): 191
-
Orozco GA
Estudio abierto prospectivo a base de rabeprazol, levofloxacina
y amoxicilina para erradicación de Helicobacterpylori
Rev Gastroenterol Mex 2006; 71 ( Supl 2 ): 94
-
Mercado U, Avendaño RM, Marin ME,
Gastelum AR, Moreno A, Franco MM
Comparación de terapia triple basada en bismuto o pantoprazol
enn pacientes con úlcer duodenal ( UD ) asociada a Helicobacter
pylori
Rev Gastroenterol Mex 2000; 65: 46
-
Huerta Iga FM
Tratamiento de la infección por Helicobacter pylori
Helicobacter pylori: cuándo y a quien tratar
SAM Esófago, Estómago y Duodeno
Sistema de Actualización Médica 2007 Libro 2:
42 – 51
Intersistemas, S. A. de C. V. México, D. F.
-
Moreno-Terrones LG
2007 DDW Tratamiento. Helicobacter pylori
Rev Gastroenterol Mex 2007; 72 ( Supl 1 ): 42 – 4
-
Peura AD
2006 DDW Helicobacter pylori abstract
Rev Gastroenterol Mex 2006; 71 ( Supl 1 ): 26 – 27
-
Larrosa HA, Martínez PEO, Coello
RP, Castillo de León YA, et al
Eficacia de dos esquemas de erradicación de Helicobacter
pylori en niños con abdominal recurrente ( DAR )
Rev Gastroenterol Mex 2004; 69 ( 2 ): 76 - 81
-
Larrosa HA, Flores MM, Garcia SO, Romero
VE, Bojorquez RMC et al
Gastritis en niños y adolescentes: infección por
Helicobacter pylori como factor de riesgo de gastritis crónica
grave y gastritis nodular
Rev Gastroenterol Mex 2006; 71 ( Supl 2 ): 164
-
Porta N, Glauser P
Oral inmunization with HELICOBACTER pylori ureas B as a treatment
agains HELICOBACTER infection in mice
Gastroenterology 1995; 109: 115 – 21
-
Sutton P, Lee A
A review article: Helicobacter pylori vaccines – the current
status
Aliment Pharmacol Ther 2000; 14: 1107 – 8
-
Taylor W
Prevention of cancer: a miss
J Ntl Cancer Inst 2007; 99 ( 2 ): 101 – 3
-
Parsonnet J
HELICOBACTER pylori: The size of the problema
Gut 1998; 43 ( suppl 1 ) 9 – 6
-
Torres J, López L, Lazcano E, Camorlinga
M, Flores L, Muñoz O
Trends in Hlicobacter pylori infection and gastric cancer in
México
Cancer Epidemiology Biomarkers and prevention 2005; 14: 1874
- 7
-
Medina FH, Heslin MJ, Cortes-González
R
Clinicophatological characteristic of gastric carcinoma in young
and elderly patients: a comparative study
Ann Surg Oncol 2000; 7: 515 – 19
-
Tanimoto WM
Helicobacter pylori: Úlcera y cáncer gástrico
Rev Gastroenterol Mex 1995; 60 ( 2 ): 112 – 3
-
López CL, Fernández OC, Robles
DG, Rascon PA, Ramírez IT
Infección por HELICOBACTER pylori y cáncer gástrico
en México. Un reto para la prevención y el control
poblacional
Rev Gastroenterol Mex 1997; 62 ( 1 ): 22 – 8
-
Megraud F
Resistance of HELICOBACTER pylori to antibiotics
Aliment Pharmacol Ther 1997; 11 ( Suppl 1 ): 43 – 53
-
Wong BC, Lam SK, Wong WM
Helicobacter pylori eradication to prevent gastric cancer in
a higt-risk region of China: a randomized control trial
JAMA 2004: 29 ( 2 ): 187 – 94
-
Blot WJ, Li JY, Taylor PR
Nutrition intervention trial in Linxian China: suplementation
with specific vitamin/ minerls combinations, cancer icidente
and disease-specific mortality in the general population
J Ntl Cancer Int 1993; 85 ( 18 ): 1483 – 92
-
Mazzari-Hiriart M, López VY, Calva
JJ, Castillo RG
Longitudinal study of microbial diversity and sensonality in
the México City Metropolitan area water supply system
Appl Environ Microbiol 2005, 71 ( 9 ): 5129 - 37
-
Viadas E, Mazari-Hiriar M, Espinosa A, Castillo
G
Desarrollan en la U.N.A.M. método para la avaluación
bacteriológica del agua
Facultad de Medicina U.N.A.M. México, D. F. 2007
-
Mazari-Hiriart M, López VY, Castillo
RG, Ponce de Leon, Cravioto A
Presence of Helicobacter pylori and other enteric bacteria in
freswater environments
Archives of Medical Research 2001; 32: 1 - 10
-
Kershenovich SD
“ Enfermedades emergentes “
Seminario “ El Ejercicio Actual de la Medicina “
División de Postgrado e Investigación
Facultad de Medicina U. N. A. M. México, D. F. 26 de
Octubre del 2007
-
INGI Dinámica Demográfica
1992
Instituto Nacional de Estadística, Geografía e
Informática México, 1992
-
Frenk J, Bobadilla J, Stern C, Frejka T,
Lozano R
Elementos para una teoría de la transición en
salud
Salud Pública México 1991; 33 ( 5 ): 448 –
62
-
Stern C, Tuiran R
Transición demográfica y desigualdad social en
México
Ponencia presentada en la IV Conferencia Latinoamericana de
Población. La transición demográfica en
américa latina y el caribe México Marzo de 1993
-
Plan Nacional de Salud 2007 – 2012
Secretaría de Salud 2007 Primera Edición, México,
D. F. 2007
-
Takats Tamas S
Significant decrease of the Helicobacter pylori infection in
Budapest ( comparision epdemiological trial base on: 1989 –
1995: 2551 patients and 1999 – 2004: 3415 patients
Rev Gastroenterol Mex 2006; 71 ( Supl 2 ): 129
|