| I. INTRODUCCIÓN
Anualmente, a nivel mundial nacen aproximadamente 130 millones
de niños; casi 3,3 millones nacen muertos y más de
4 millones fallecen en los primeros 28 días de vida. Los
nacimientos prematuros y las malformaciones congénitas causan
más de una tercera parte de las muertes neonatales, la mayoría
en la primera semana de vida. Otro 25% de las muertes neonatales
se producen por asfixia, sobre todo en el periodo neonatal temprano.
Si bien no existen estadísticas certeras sobre la magnitud
del problema de asfixia neonatal, representa una de las principales
causas de muerte, y estimaciones por la Organización Mundial
de la Salud (OMS) señalan que más de un millón
de recién nacidos que sobreviven la asfixia desarrollan parálisis
cerebral, problemas de aprendizaje y otros problemas del desarrollo.
(1,2) Más aún, se estima que el número de años
vida ajustados por incapacidad (DALYs) asociados a asfixia exceden
a las condiciones que pueden ser prevenidas por inmunizaciones;
debido a esto se debe dar más atención a este grave
problema de salud pública. (3)
Las muertes fetales, especialmente las consideradas
“frescas” (piel sin maceración), pueden indicar
que el daño ocurrió al momento del parto (o en un
periodo no mayor a 12 hrs previas) por una asfixia grave. (4) Se
calcula que el número de muertes fetales intra-parto es mayor
que el número de muertes neonatales en este mismo periodo.
(5) Así, un estudio reportado por la Organización
Mundial de la Salud estimó que 26% de los óbitos a
nivel mundial ocurren al momento del parto (6). Esta cifra es alarmante
ya que estas muertes pueden evitarse con buenas prácticas
obstétricas. Estos datos indican que cuando se habla de asfixia
perinatal es importante considerar también muertes fetales
frescas. Desgraciadamente esta información no está
disponible en la mayoría de los países donde existe
el mayor número de muertes por asfixia.
1. Mortalidad neonatal.
La mortalidad neonatal es el indicador que se usa para expresar
el riesgo de fallecer o las expectativas de sobrevida de los recién
nacidos durante los primeros 28 días de vida. Este indicador
se subdivide en mortalidad neonatal temprana entre 1 y 6 días,
y mortalidad neonatal tardía entre 7 y 28 días. Este
parámetro indica las condiciones de embarazo y parto de una
población que a su vez está relacionado con su estado
socioeconómico y con la oportunidad y calidad de atención
de los servicios de salud (3). A nivel global, las muertes neonatales
representan 37% de la mortalidad en niños menores de 5 años
de edad y esta proporción aumenta a medida que la mortalidad
pos-neonatal disminuye. (7) La mortalidad neonatal depende de varios
factores que no están confinados exclusivamente al área
médica hospitalaria. La comunidad tiene un papel muy importante,
se deben realizar programas de educación general y en salud
reproductiva; asimismo, se debe asegurar una buena nutrición
y suplementar con ácido fólico a la mujer en edad
reproductiva. Las comunidades deben tener acceso a centros de salud
y clínicas de diferentes niveles de atención, que
puedan prevenir o resolver de manera oportuna problemas de salud
perinatal. Es imperativo regionalizar los sistemas de salud y asegurar
una comunicación adecuada entre los diferentes centros de
atención médica. Es importante fortalecer el cuidado
prenatal, la atención del parto por personal calificado y
la infraestructura y el proceso de atención de las diversas
instituciones de salud.
A nivel mundial, se ha estimado que las principales
causas de muerte neonatal son prematuridad (28%), infecciones (26%
[Incluye tétanos, diarrea] y asfixia (23%). Las malformaciones
congénitas son responsables del 7-8% de la mortalidad neonatal.
La mayoría de las muertes neonatales (75%) ocurren en la
primera semana y la mayor parte de éstas en las primeras
24 hrs de vida. (2) De tal manera que existe una ventana “pequeña”
de acción que puede permitir un gran campo de acción.
Después de la primera semana de vida, las
enfermedades infecciosas respiratorias, gastrointestinales y tétanos
neonatal representan la tercera parte de la mortalidad neonatal.
(1)
Se ha logrado una importante disminución
de la mortalidad infantil pos-neonatal en muchos países del
mundo incluyendo México; esto debido a la acertada implementación
de programas de salud pública como el programa de vacunación
universal, uso de vida suero oral para la prevención de deshidratación
grave por diarreas y manejo oportuno de infecciones respiratorias.
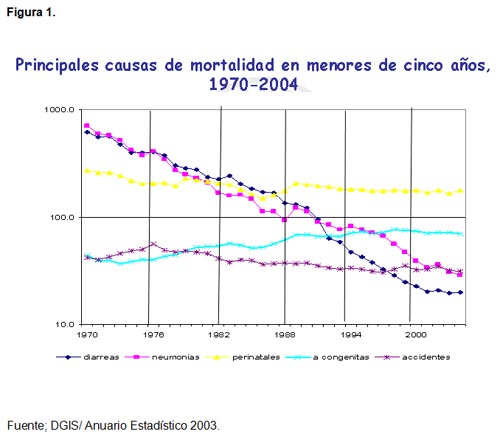
(8-11) La Figura 1 muestra claramente como en México, en
las últimas tres décadas, la mortalidad asociada a
neumonías y diarreas ha disminuido notablemente en población
menor de cinco años de edad; también es claro que
las muertes originadas en el periodo neonatal han tenido una disminución
marginal. Asimismo, es de interés notar el papel cada vez
mayor que las malformaciones congénitas tienen como proporción
de mortalidad en este grupo etáreo.
II. DEFINICIÓN
1. Asfixia.
Una de las dificultades más importantes para analizar el
problema de asfixia desde el punto de vista epidemiológico
es la falta de una definición estándar de esta condición.
Esto no ha permitido analizar la verdadera “carga de la enfermedad”
asociada a la misma, especialmente a nivel de la comunidad, que
es donde está el mayor riesgo.
El término asfixia viene del griego A=(negación
o privación) y “sphixis”=pulso. La asfixia es
un síndrome caracterizado por la suspensión o grave
disminución del intercambio gaseoso a nivel de la placenta
o de los pulmones, que resulta en hipoxemia, hipercapnia e hipoxia
tisular con acidosis metabólica. La hipoxia fetal puede producirse
por causas que afecten a la madre, a la placenta y/o cordón
umbilical o al propio feto. La asfixia perinatal puede ocurrir antes
del nacimiento, durante el trabajo de parto o en el periodo neonatal
Históricamente se utilizaban los términos
Asphyxia pallida y livida. Los neonatos que tenían
asphyxia pallida eran los que estaban más gravemente
afectados y que requerían resucitación inmediata.
(12) En el año 1952 la doctora Virginia Apgar propuso un
puntaje para “calificar” a los recién nacidos
al momento de nacer. Este puntaje, especialmente el muy bajo (<4)
a los cinco minutos de vida, se aceptó universalmente especialmente
para predecir mortalidad. (13) En un estudio realizado en ocho hospitales
de México (7 en la Ciudad de México y uno en Oaxaca)
se analizaron 27, 227 nacimientos; de éstos, 59 recién
nacidos tuvieron un Apgar <4 a los cinco minutos (2.6/1000 nacimientos)
y la mortalidad en estos neonatos con Apgar muy bajo fue de 73%.
Al analizar exclusivamente a los recién nacidos a término
(24,230 neonatos), el riesgo de morir entre aquellos con Apgar <4
a los cinco minutos fue 138 veces mayor (IC 95% 75-252) que aquellos
con Apgar >6. (14) Esto apoya el papel que el puntaje de Apgar
a los cinco minutos tiene como predictor de muerte neonatal, inclusive
en nuestro medio y a más de cincuenta años que la
doctora Apgar publicara el artículo original sobre la utilidad
de su herramienta. Sin embargo, el papel del puntaje bajo de Apgar
como indicador de asfixia perinatal y/o como predictor de secuelas
a largo plazo es cuestionado. Por ejemplo, un recién nacido
pretérmino sano puede normalmente tener puntajes de Apgar
más bajos que neonatos a término, ya que el tono,
color e irritabilidad refleja dependen la madurez fisiológica
del neonato. (15) La Academia Americana de Pediatría (AAP)
y el Colegio Americano de Obstetras y Ginecólogos (ACOG)
(16,17) propusieron que se defina asfixia cuando se cumplan los
siguientes criterios:
- Ph de arteria de cordón umbilical < 7.0
- Apgar <4 a los cinco minutos manifestaciones neurológicas
anormales (convulsiones, coma, hipotonía, etc.)
- Disfunción multiorgánica (alteraciones cardiovasculares,
gastrointestinales, hematológicas, pulmonares, renales,
etc.)
El problema con esta definición es que
en países en desarrollo y a nivel de la comunidad es muy
difícil poder contar con gasometrías o con determinaciones
adecuadas del puntaje de Apgar. De igual manera, en casos de muertes
inmediatas o en condiciones en las que un bebé no recibe
resucitación, no es factible definir asfixia según
los parámetros previamente establecidos. Debido a esto, es
URGENTE trabajar en una definición práctica de asfixia
que pueda utilizarse en los lugares y en las condiciones donde este
problema se presenta con mayor frecuencia. Es claro que con los
datos que tenemos ahora se subestima el problema a nivel global.
2. ENCEFALOPATÍA HIPÓXICA
ISQUÉMICA
La encefalopatía Hipóxico-Isquémica (EHI) representa
los cambios bioquímicos, las manifestaciones clínicas
y/o lesión estructural derivadas de la isquemia cerebral
(reducción del flujo sanguíneo), frecuentemente, aunque
no necesariamente, asociada con hipoxemia (reducción de la
cantidad de oxígeno en la sangre), la cual suele causar daño
por las alteraciones cardiovasculares y las fallas de autorregulación
cerebral.
III. ASPECTOS EPIDEMIOLÓGICOS EN
MÉXICO
La incidencia de la asfixia varía según los diferentes
centros y la definición diagnóstica que se le da.
La Secretaría de Salud en México agrupa a la asfixia
perinatal y entidades nosológicas relacionadas, de acuerdo
a la CIE 10 con las categorías presentadas en el Cuadro
1.
Cuadro
1. Asfixia perinatal y entidades nosológicas relacionadas
de acuerdo a la CIE 10. |
| P20 |
Hipoxia intrauterina |
| P21 |
Asfixia al nacimiento |
| P22 |
Dificultad respiratoria del recién nacido |
| P23 |
Neumonía congénita |
| P24 |
Síndromes de aspiración neonatal |
| P25 |
Enfisema intersticial y afecciones relacionadas, originadas
en el periodo perinatal |
| P26 |
Hemorragia pulmonar originada en el periodo perinatal |
| P27 |
Enfermedad respiratoria crónica originada en el periodo
perinatal |
| P28 |
Otros problemas respiratorios del recién nacido, originados
en el periodo perinatal |
| |
|
| Fuente: Bases de datos de defunciones,
1979-2003. INEGI/Secretaría de Salud |
En el Cuadro 2 se puede analizar
como la asfixia tiene un papel importante como responsable de muertes
neonatales en México.
Es interesante notar que en el año 1979
y a principios de los 80´s, la hipoxia intrauterina (SDR)
tenían un peso similar como responsables de asfixia. Sin
embargo, en los últimos años SDR toma un papel más
importante como responsable de asfixia. Estos datos podrían
sugerir que el manejo gineco-obstétrico y la atención
al momento del parto han mejorado, pero que se debe hacer más
énfasis en el manejo de SDR. Actualmente, existe surfactante
exógeno y mejores ventiladores para el manejo de SDR, por
lo que fortalecer su uso podría considerarse para abatir
los problemas asociados a este problema neonatal. De igual manera,
se debe promover el uso de esteroides prenatales en embarazos de
alto riesgo, ya que esta simple y barata medida ha demostrado disminuir
la mortalidad, así como la incidencia de SDR y de hemorragia
intraventricular en recién nacidos pretérmino (18-20).
En un estudio realizado en el Hospital Infantil de México,
se detectó que solo 12% de los recién nacidos pretérmino
que ingresaron a las salas de neonatología habían
recibido esteroides prenatales y la mayor parte de ellos habían
recibidos dosis y ciclos incorrectos. (21)
Cuadro
2. Defunciones por asfixia al nacer* y causa, según
año de registro nacional 1979-2003. |
| Año Registro |
Hipoxia intrauterina y asfixia
al nacer CIE 9 768 y CIE 10 P20, P21 |
Síndrome de dificultad
respiratoria 769, P22 |
Otras afecciones respiratorias
del feto y del recién nacido 770, P23-P28 |
Total |
1979 |
2252 |
2251 |
7048 |
11551 |
1980 |
2133 |
2650 |
7138 |
11921 |
1981 |
2131 |
2969 |
7144 |
12244 |
1982 |
2491 |
3134 |
6737 |
12362 |
1983 |
2284 |
3279 |
6319 |
11882 |
1984 |
2398 |
3699 |
6070 |
12167 |
1985 |
2181 |
3564 |
5625 |
11370 |
1986 |
1897 |
3977 |
4803 |
10677 |
1987 |
1938 |
4506 |
4944 |
11388 |
1988 |
1985 |
5063 |
5468 |
12516 |
1989 |
2345 |
5609 |
5586 |
13540 |
1990 |
2388 |
5780 |
5157 |
13325 |
1991 |
2338 |
5993 |
4937 |
13268 |
1992 |
2140 |
6278 |
4684 |
13102 |
1993 |
2044 |
6158 |
4263 |
12465 |
1994 |
1895 |
6388 |
4152 |
12435 |
1995 |
1816 |
6475 |
3882 |
12173 |
1996 |
1690 |
6183 |
3611 |
11484 |
1997 |
1630 |
6372 |
3738 |
11740 |
1998 |
1759 |
6424 |
3695 |
11878 |
1999 |
1726 |
6036 |
4006 |
11768 |
2000 |
1715 |
5838 |
4014 |
11567 |
2001 |
1615 |
5379 |
3879 |
10873 |
2002 |
1733 |
5539 |
3665 |
10937 |
2003 |
1634 |
5275 |
3368 |
10277 |
En los Cuadros 3 y 4 se desglosan las defunciones
infantiles por grupos de edad, ciertas afecciones originadas en
el período perinatal y asfixia al nacer, respectivamente
y se puede observar como el número total de muertes neonatales
por asfixia no ha cambiado dramáticamente
en las últimas décadas.
En el 2003 se registraron 2.271.700 nacimientos
en México y 20,806 defunciones neonatales; la principal causa
de muerte neonatal ese año fue la asfixia al nacer con 10,277
decesos, lo que representa que respecto al total de mortalidad neonatal,
el 49.4 por ciento de las defunciones fueron por asfixia al nacimiento.
También se puede observar que en 1979 aproximadamente
10% de las muertes infantiles eran asociadas a asfixia, sin embargo,
a medida que la mortalidad infantil por causas específicas
como sarampión, diarreas e infecciones respiratorias se fue
abatiendo, esta cifra ascendió hasta 30% en el año
2003.
| Cuadro
3. Defunciones infantiles por grupos de edad, ciertas afecciones
originadas en el período perinatal y asfixia al nacer*,
según año de registro Nacional, 1979-2003 |
| Año
Registro |
Infantil |
Ciertas
afecciones originadas en el período perinatal |
Asfixia
al nacer |
%1/ |
%2/
|
%3/ |
| Neonatal Temprana
(Menores 7 días) |
Neonatal Tardia
(7 a 27 días) |
Neonatal (0
a 28 días) |
Posneonatal
(28 días a 11 meses) |
No especificado |
Total |
1979 |
26,942 |
12,714 |
39,656 |
55,316 |
2,631 |
97,603 |
26,397 |
11,551 |
11.8 |
29.1 |
43.8 |
1980 |
26,266 |
12,680 |
38,946 |
55,281 |
2,691 |
96,918 |
25,940 |
11,921 |
12.3 |
30.6 |
46.0 |
1981 |
25,934 |
11,899 |
37,833 |
49,525 |
2,897 |
90,255 |
25,848 |
12,244 |
13.6 |
32.4 |
47.4 |
1982 |
24,502 |
10,817 |
35,319 |
43,737 |
3,268 |
82,324 |
25,091 |
12,362 |
15.0 |
35.0 |
49.3 |
1983 |
24,475 |
9,986 |
34,461 |
44,084 |
1,965 |
80,510 |
23,563 |
11,882 |
14.8 |
34.5 |
50.4 |
1984 |
21,689 |
9,577 |
31,266 |
41,972 |
3,615 |
76,853 |
23,102 |
12,167 |
15.8 |
38.9 |
52.7 |
1985 |
19,564 |
8,584 |
28,148 |
38,491 |
2,682 |
69,321 |
20,771 |
11,370 |
16.4 |
40.4 |
54.7 |
1986 |
18,873 |
7,693 |
26,566 |
33,950 |
2,360 |
62,876 |
19,072 |
10,677 |
17.0 |
40.2 |
56.0 |
1987 |
19,297 |
7,823 |
27,120 |
37,242 |
43 |
64,405 |
20,319 |
11,388 |
17.7 |
42.0 |
56.0 |
1988 |
20,621 |
7,143 |
27,764 |
32,097 |
1,942 |
61,803 |
21,855 |
12,516 |
20.3 |
45.1 |
57.3 |
1989 |
24,078 |
7,736 |
31,814 |
35,251 |
250 |
67,315 |
23,453 |
13,540 |
20.1 |
42.6 |
57.7 |
1990 |
24,139 |
7,364 |
31,503 |
33,864 |
130 |
65,497 |
22,916 |
13,325 |
20.3 |
42.3 |
58.1 |
1991 |
23,202 |
6,920 |
30,122 |
26,891 |
78 |
57,091 |
22,236 |
13,268 |
23.2 |
44.0 |
59.7 |
1992 |
22,879 |
6,334 |
29,213 |
23,174 |
115 |
52,502 |
21,676 |
13,102 |
25.0 |
44.8 |
60.4 |
1993 |
21,711 |
5,867 |
27,578 |
21,948 |
105 |
49,631 |
20,908 |
12,465 |
25.1 |
45.2 |
59.6 |
1994 |
21,391 |
6,190 |
27,581 |
21,678 |
46 |
49,305 |
20,549 |
12,435 |
25.2 |
45.1 |
60.5 |
1995 |
21,052 |
6,270 |
27,322 |
20,672 |
29 |
48,023 |
20,483 |
12,173 |
25.3 |
44.6 |
59.4 |
1996 |
19,952 |
6,382 |
26,334 |
19,344 |
29 |
45,707 |
19,675 |
11,484 |
25.1 |
43.6 |
58.4 |
1997 |
19,809 |
6,371 |
26,180 |
18,181 |
16 |
44,377 |
19,799 |
11,740 |
26.5 |
44.8 |
59.3 |
1998 |
19,279 |
6,212 |
25,491 |
16,395 |
297 |
42,183 |
19,869 |
11,878 |
28.2 |
46.6 |
59.8 |
1999 |
17,889 |
5,919 |
23,808 |
15,990 |
485 |
40,283 |
19,261 |
11,768 |
29.2 |
49.4 |
61.1 |
2000 |
17,533 |
5,989 |
23,522 |
14,697 |
402 |
38,621 |
19,388 |
11,567 |
30.0 |
49.2 |
59.7 |
2001 |
16,452 |
5,637 |
22,089 |
13,456 |
366 |
35,911 |
18,199 |
10,873 |
30.3 |
49.2 |
59.7 |
2002 |
16,585 |
5,958 |
22,543 |
13,713 |
311 |
36,567 |
18,573 |
10,937 |
29.9 |
48.5 |
58.9 |
2003 |
15,379 |
5,427 |
20,806 |
12,290 |
259 |
33,355 |
17,077 |
10,277 |
30.8 |
49.4 |
60.2 |
| |
|
|
|
|
|
|
|
|
|
|
|
| * Códigos CIE-9 (768-770), CIE-10(P20-P28)
|
| %1/ Porcentaje de las defunciones por asfixia
al nacimiento respecto al total infantil |
| %2/ Porcentaje de las defunciones por asfixia
al nacimiento respecto al total neonatal |
| %3/ Porcentaje de las defunciones por asfixia
al nacimiento respecto al total ciertas afecciones originadas
en el periodo perinatal |
| Fuente: Bases de datos de defunciones, 1979-2003.
INEGI/Secretaría de Salud |
| Cuadro
4. Defunciones por asfixia al nacer* y grupos de edad, según
año de registro nacional 1979-2003 |
| Año
Registro |
Neonatal Temprana
(Menores 7 días) |
Neonatal Tardía
(7 a 27 días) |
Neonatal |
Posneonatal
(28 días a 11 meses) |
No especificado |
Total |
Muertes asfixia
/1000 NVE* |
1979 |
8,788 |
1,069 |
9,857 |
221 |
1,473 |
11,551 |
4.6 |
1980 |
9,125 |
1,098 |
10,223 |
203 |
1,311 |
11,921 |
4.7 |
1981 |
9,351 |
1,123 |
10,474 |
147 |
1,623 |
12,244 |
4.9 |
1982 |
9,309 |
1,092 |
10,401 |
162 |
1,799 |
12,362 |
4.9 |
1983 |
9,657 |
1,108 |
10,765 |
201 |
916 |
11,882 |
4.7 |
1984 |
8,721 |
1,063 |
9,784 |
200 |
2,183 |
12,167 |
4.8 |
1985 |
8,299 |
1,130 |
9,429 |
335 |
1,606 |
11,370 |
4.5 |
1986 |
7,853 |
1,045 |
8,898 |
300 |
1,479 |
10,677 |
4.3 |
1987 |
8,702 |
1,088 |
9,790 |
1,598 |
|
11,388 |
4.5 |
1988 |
9,804 |
1,103 |
10,907 |
495 |
1,114 |
12,516 |
5 |
1989 |
11,672 |
1,276 |
12,948 |
478 |
114 |
13,540 |
5.4 |
1990 |
11,645 |
1,179 |
12,824 |
452 |
49 |
13,325 |
5.3 |
1991 |
11,573 |
1,171 |
12,744 |
489 |
35 |
13,268 |
5.3 |
1992 |
11,430 |
1,211 |
12,641 |
423 |
38 |
13,102 |
5 |
1993 |
10,881 |
1,125 |
12,006 |
415 |
44 |
12,465 |
5.1 |
1994 |
10,776 |
1,227 |
12,003 |
412 |
20 |
12,435 |
5.1 |
1995 |
10,456 |
1,295 |
11,751 |
409 |
13 |
12,173 |
5.1 |
1996 |
9,829 |
1,311 |
11,140 |
330 |
14 |
11,484 |
5 |
1997 |
9,979 |
1,310 |
11,289 |
444 |
7 |
11,740 |
5.2 |
1998 |
9,725 |
1,615 |
11,340 |
413 |
125 |
11,878 |
5.4 |
1999 |
9,292 |
1,871 |
11,163 |
394 |
211 |
11,768 |
5.4 |
2000 |
8,951 |
1,949 |
10,900 |
480 |
187 |
11,567 |
5.4 |
2001 |
8,413 |
1,804 |
10,217 |
480 |
176 |
10,873 |
5.2 |
2002 |
8,443 |
1,828 |
10,271 |
520 |
146 |
10,937 |
5.3 |
2003 |
7,904 |
1,689 |
9,593 |
545 |
139 |
10,277 |
5 |
| |
|
|
|
|
|
|
|
| Códigos CIE-9 (768-770), CIE-10(P20-P28) |
| NVE= Nacimientos Vivos Estimados |
| Fuente: Bases de datos de defunciones, 1979-2003.
INEGI/Secretaría de Salud |
En el Cuadro 5 se presenta la
distribución de muertes por asfixia perinatal según
tipo de derecho-habiencia, El 63% de las muertes por asfixia corresponden
a la Secretaría de Salud (no derechohabientes) y 36% al IMSS,
proporciones equivalentes al porcentaje de la cohorte que les corresponde,
lo que indica que no hay diferencia por institución, no obstante
que el 100% de los partos del IMSS son atendidos en hospitales.
| Cuadro
5. Defunciones por asfixia al nacer* y tipo de derecho-habiencia,
según año de registro Nacional, 1989-2003 |
Año Registro |
Ninguna |
IMSS |
ISSSTE |
PEMEX |
SEDENA |
Otra |
Mas de una (multirespuesta) |
No especificado |
Total |
| 1989 |
6,259 |
3,525 |
474 |
85 |
65 |
251 |
2 |
2,879 |
13,540 |
| 1990 |
6,439 |
3,663 |
433 |
76 |
63 |
216 |
3 |
2,432 |
13,325 |
| 1991 |
6,733 |
3,782 |
432 |
49 |
61 |
201 |
5 |
2,005 |
13,268 |
| 1992 |
6,524 |
3,790 |
409 |
44 |
53 |
208 |
3 |
2,071 |
13,102 |
| 1993 |
6,474 |
3,559 |
347 |
51 |
64 |
196 |
3 |
1,771 |
12,465 |
| 1994 |
6,709 |
3,381 |
401 |
34 |
82 |
220 |
5 |
1,603 |
12,435 |
| 1995 |
6,902 |
3,046 |
382 |
34 |
63 |
215 |
3 |
1,528 |
12,173 |
| 1996 |
6,767 |
2,776 |
374 |
33 |
73 |
228 |
2 |
1,231 |
11,484 |
| 1997 |
6,863 |
2,770 |
378 |
35 |
90 |
241 |
6 |
1,357 |
11,740 |
| 1998 |
7,171 |
2,708 |
348 |
40 |
75 |
184 |
2 |
1,350 |
11,878 |
| 1999 |
7,120 |
2,764 |
329 |
38 |
73 |
209 |
2 |
1,233 |
11,768 |
| 2000 |
6,989 |
2,675 |
325 |
27 |
58 |
230 |
1 |
1,262 |
11,567 |
| 2001 |
6,728 |
2,513 |
260 |
32 |
52 |
206 |
|
1,082 |
10,873 |
| 2002 |
6,854 |
2,553 |
259 |
37 |
57 |
177 |
1 |
999 |
10,937 |
| 2003 |
6,415 |
2,294 |
273 |
26 |
56 |
189 |
1 |
1,023 |
10,277 |
| |
|
|
|
|
|
|
|
|
|
| * Códigos CIE-9 (768-770), CIE-10(P20-P28) |
| Fuente: Bases de datos de defunciones, 1979-2003.
INEGI/Secretaría de Salud |
Más aún, si se analizan tasas por
1000 nacimientos de población estimada, las cifras indican
que hay un aumento ligero en la mortalidad por asfixia (4.6 ->5/1000
nacimientos vivos estimados; 1979 vs. 2003, respectivamente); esto
inclusive a finales de los 90´s cuando ya se había
instituido el Programa Nacional de Reanimación Neonatal en
México. Esto habla de la necesidad de PREVENIR condiciones
que se asocien a asfixia, además de reanimar adecuadamente
a un neonato, para tener un mayor impacto positivo en la sobrevida
neonatal.
Como se mencionó anteriormente, las muertes
fetales “frescas” también representan muertes
por asfixia. En México se tiene poca información con
respecto al número de muertes fetales sin maceración.
Sin embargo, INEGI reporta número de muertes fetales por
año. En el cuadro 6 se presentan las tasas de mortalidad
fetal por 1000 nacimientos registrados. Esta ha disminuido de 10.8
a 9.6 en los últimos 16 años. Si tomamos en cuenta
las estimaciones realizadas por la OMS en las que se calcula que
el 26% de las muertes fetales ocurren intra-parto, es claro que
las muertes por asfixia serán mucho mayores que si solo se
consideraran las muertes neonatales (7.5-8 muertes por asfixia fetal/neonatal/1000
nacimientos). Sin embargo, nuevamente este problema puede estar
subestimado ya que muchas muertes fetales no se registran. Es posible
que por esta razón en México la proporción
de muertes neonatales por asfixia sea mayor que la de muertes fetales
por esta causa.
| Cuadro
6. Tasa de Mortalidad Fetal 1990-2006 |
Año de
registro |
Número
de fetos registrados |
Mortalidad fetal* |
1990 |
29519 |
10.8 |
1991 |
29456 |
10.7 |
1992 |
29644 |
10.6 |
1993 |
28772 |
10.1 |
1994 |
28734 |
9.9 |
1995 |
28201 |
10.3 |
1996 |
27157 |
10.0 |
1997 |
27135 |
10.1 |
1998 |
28120 |
10.5 |
1999 |
27604 |
10.0 |
2000 |
26958 |
9.6 |
2001 |
25567 |
9.2 |
2002 |
25109 |
9.3 |
2003 |
25011 |
9.4 |
2004 |
24836 |
9.5 |
2005 |
24494 |
9.5 |
2006 |
23986 |
9.6 |
En el grupo NEOSANO, que es una red colaborativa
para el estudio de salud perinatal en poblaciones mexicanas, se
detectó que 61 a 85% de las muertes fetales en dos poblaciones
de estudio (un hospital en la Ciudad de México y otro en
la Ciudad de Oaxaca) ocurridas de Agosto 2006- Mayo 2007 correspondía
a muertes “frescas” [datos no publicados]. Esta figura
es muy preocupante pues indica que en estas poblaciones, la mayoría
de las muertes fetales ocurrieron al momento del parto y que se
pudieron haber evitado. Este tipo de información es muy importante
ya que permite establecer estrategias de intervención mediante
prácticas obstétricas de emergencia. Se debe hacer
un esfuerzo nacional para analizar muertes fetales con los datos
de las características de la piel para así establecer
si la muerte ocurrió intra-parto o no.
IV. ETIOPATOGENIA
1. Encefalopatía hipóxica isquémica.
El daño neurológico final en pacientes asfixiados
es secundario a hipoxia o isquemia y a alteraciones en otros sistemas
neuroquímicos, como los aminoácidos excitatorios,
calcio, radicales libres, oxido nítrico, citocinas pro-inflamatorias,
lípidos bioactivos, etc.; también se ha estudiado
la apoptosis y los cambios vasculares asociados con el síndrome
de reperfusión.
Durante el periodo neonatal el cerebro puede quedar
privado de oxígeno por dos mecanismos patógenos importantes:
la hipoxemia y la isquemia. Durante la isquemia las concentraciones
de glucosa disminuyen y además se produce acidosis metabólica.
El cerebro capta glucosa desde la sangre mediante un proceso de
difusión facilitada que depende de trasportadores proteicos,
pero el cerebro inmaduro contiene concentraciones bajas de estas
proteínas lo que hace que el transporte y la utilización
de la glucosa sean limitados, facilitando el daño.
Los cambios bioquímicos de la asfixia incluyen:
-
Hipercapnia, que puede conservar el flujo
sanguíneo cerebral e incluso lo puede incrementar.
-
Disminución del índice metabólico
cerebral.
-
Disminución del pH intracelular.
La acidemia a su vez favorece una desviación a la derecha
de la curva de disociación de oxígeno-hemoglobina,
de modo que disminuye la afinidad de la hemoglobina por el oxígeno
con un aumento del suministro de oxígeno hacia las células.
-
Los efectos de la hipoxia pueden dar disminución
de glucógeno y fosfocreatina en el cerebro e incremento
del lactato. Esto va seguido por baja de glucosa y de ATP, asociado
a falla mitocondrial. En condiciones de hipoxia se activa la
glicólisis anaerobia y se generan sólo dos moléculas
de ATP por cada molécula de glucosa metabolizada. La
glucólisis se acelera 5 a 10 veces y se intenta satisfacer
esta necesidad de glucosa mediante una combinación de
glucogenólisis e incremento de la captación neta
de glucosa a partir de la sangre. A pesar de esta aceleración
es imposible satisfacer las demandas de energía que requiere
el cerebro y las cifras de ATP empiezan a disminuir después
de dos minutos y bajan a 30% después de seis minutos
(logrando preservar el estado de energía de la sustancia
gris, no así en la sustancia blanca). La falla energética
altera la recaptura de glutamato, lo que da por resultado su
acumulación extracelular, misma que provoca una sobre-estimulación
tónica de los receptores post-sinápticos excitatorios.
El resultado final de la insuficiencia de energía es
una cascada de sucesos que incluyen acumulación de aminoácidos
excitotóxicos, calcio citosólico, activación
de fosfolipasas, generación de radicales libres y una
serie de acontecimientos metabólicos relacionados que
conducen a muerte celular. Existe evidencia experimental considerable
que sugiere que el cerebro neonatal es altamente susceptible
al daño mediado por los radicales libres, los cuales
pueden dañar directamente el DNA, proteínas, lípidos
de la membrana y pueden iniciar la apoptosis, además
de reactivar el óxido nítrico para producir radicales
peroxinitritos altamente tóxicos.
Reperfusión: Después de un periodo
de isquemia viene la reperfusión. Durante este periodo y
con la reoxigenación, puede haber un deterioro cerebral en
una fase secundaria tardía que va de 6 a 48hrs.
V. CUADRO CLÍNICO
El paciente asfixiado puede tener encefalopatía hipóxico-isquémica
y daño multiorgánico. Debido a esto, las manifestaciones
clínicas están relacionadas a la presencia de estos
problemas.
1. Encefalopatía hipóxico-isquémica.
La aparición de un síndrome neurológico neonatal
identificable es el indicador más útil de que ha ocurrido
un daño de origen hipóxico-isquémico importante
en el cerebro. La gravedad y duración del síndrome
neurológico neonatal tiene gran valor ya que se correlaciona
directamente con la incidencia de secuelas neurológicas.
-
Manifestaciones clínicas tempranas
Del nacimiento hasta la 12 horas. El lactante gravemente
afectado presenta estupor profundo o coma. Es frecuente que
haya respiración periódica o irregularidades respiratorias.
Las respuestas pupilares a la luz están intactas, hay
movimientos oculares espontáneos y la maniobra de ojos
de muñeca es completa. El tamaño de la pupila
es variable, aunque las pupilas tienden a estar dilatadas y
reactivas en los lactantes menos afectados y reactivas y mióticas
en lactantes más afectados. La mayoría de los
neonatos en esta etapa muestra hipotonía. Las crisis
convulsivas se presentan entre las 6 a 12 horas de nacimiento
en el 50 al 60% de los afectados, la mayoría de ellos
manifestadas por movimientos sutiles, como desviación
de la mirada conjugada o chupeteo, asociado con alteración
de conciencia. Los prematuros pueden manifestar reacciones de
descerebración que pueden simular crisis convulsivas
tónicas generalizadas.
De 12 a 24 horas. En esta etapa el nivel de conciencia
cambia de una manera variable, los neonatos con enfermedad grave
permanecen estuporosos o en coma y los menos graves a menudo
muestran cierto grado de mejoría del estado de alerta,
que es más aparente que real ya que no se acompañe
de fijación o seguimiento visual. Las crisis convulsivas
son intensas y hay periodos de apnea, agitación y debilidad.
Puede presentarse estado epiléptico el cual requiere
tratamiento agresivo y urgente. Puede haber apneas y agitación.
De 24 a 72 horas. El nivel de conciencia en los casos
graves se deteriora más y sobreviene el estupor profundo
o coma (aparece paro respiratorio y son frecuentes las alteraciones
oculomotoras del tallo cerebral). Las pupilas pueden quedar
fijas a la luz en posición media, o dilatadas. Los que
fallecen por encefalopatía hipóxica- isquémica
lo hacen con mayor frecuencia durante este periodo.
Después de las 72 horas. Los neonatos que sobreviven
hasta este periodo por lo general mejoran en el transcurso de
días a semanas, las alteraciones de la alimentación
son frecuentes y se relacionan con anormalidades de la succión,
la deglución y los movimientos de la lengua. La hipotonía
generalizada de las extremidades es característica y
algunos pueden mostrar hipertonía, sobretodo aquellos
con afección de los ganglios de la base.
Las alteraciones oculomotoras se relacionan con alteración
de los núcleos de los pares craneales III, IV, VI, los
trastornos de la succión deglución y movimientos
de la lengua están en relación a la afección
del tallo cerebral.
-
El examen neurológico del
neonato asfixiado
La exploración neurológica del recién nacido
es diferente a la que se realiza en otras edades, si bien comprende
un examen físico detallado, debe incluir además
un análisis de los reflejos primitivos y exige un conocimiento
de los cambios físicos vistos en neonatos pretérmino
(normales y anormales) y en neonatos que fueron sometidos a
asfixia en diferentes etapas de tiempo, con su recuperación
y sus complicaciones.
La exploración del recién nacido debe realizarse
en un sitio tranquilo, iluminado y a temperatura adecuada, para
que el recién nacido se encuentre cómodo después
de quitarle la ropa. La ropa debe retirarse de manera lenta
y delicada, el pañal solo se retirará durante
el tiempo en que se evalúa la zona que cubre (genitales,
caderas y abdomen). Idealmente la exploración debe efectuarse
el segundo o tercer día de vida, algunas horas después
de la alimentación y con el niño despierto, sin
llanto y no hambriento.
Pasos importantes en la exploración:
-
Observación.
La exploración debe comenzar por la observación,
es un error empezar a manipular al niño sin un período
adecuado de observación. Debe buscarse la presencia
de anomalías congénitas, como defectos de
la línea media del cráneo, cara, paladar y
columna vertebral. Las anomalías del tronco, miembros
y piel se descubren fácilmente. Las alteraciones
de la pigmentación de la piel son importantes debido
a los orígenes ectodérmicos comunes de los
tegumentos y del sistema nervioso (síndromes neurocutáneos).
Además es importante observar la posición
de las extremidades para evaluar el tono muscular pasivo.
Un movimiento simétrico de las extremidades, con
ligera flexión de las articulaciones de los codos
y rodillas, con un abrir y cerrar espontáneo de las
manos es normal en el neonato de término, mientras
que mantener los codos adheridos a la cama con poca movilidad
de las manos puede ser normal antes de las 32 semanas de
gestación. En general existe una distancia suficiente
para pasar dos dedos entre la cama de exploración
y el cuello del paciente, mientras que distancias mayores
pueden indicar hipertonía de los extensores del cuello
y distancia menores pueden representar hipotonía;
la primera como dato de asfixia crónica (in utero)
y la segunda como dato de asfixia aguda en las primeras
horas. Una motilidad asimétrica y una mano empuñada
asimétrica debe ser siempre considerada como anormalidad.
Hay que recordar que la hipomotilidad fetal de origen neurológico
provoca alteraciones físicas en los neonatos que
deben reconocerse como el pie aducto bilateral, luxación
de cadera, pobre esfuerzo respiratorio, pobre esfuerzo de
succión, flacidez generalizada, etc., que pueden
condicionar asfixia.
-
Cabeza. La evaluación
de la cabeza comprende las características externas
como el perímetro cefálico, forma y características
de la piel. En la piel debe descartarse la presencia de
masas (encefalocele, tumor), lesiones cutáneas como
malformaciones vasculares congénitas. Es normal observar
cierto abombamiento de la fontanela anterior con el llanto.
El perímetro cefálico es la medida que nos
informa sobre el volumen intracraneal, tanto del cerebro
como del líquido cerebroespinal; en menor grado esta
medida se encuentra afectada por el espacio subdural y subaracnoideo,
o por el volumen de sangre intracraneal. Un perímetro
cefálico reducido en los primeros días de
vida en un niño asfixiado debe de hacer sospechar
de una patología cerebral previa a la asfixia. Existen
alteraciones como la craneosinostosis, que es el cierre
prematuro de las suturas craneales donde puede estar afectada
una o varias suturas, lo que ocasiona alteraciones y asimetrías
en la forma del cráneo, provocando siempre deformidad
y no microcefalia, en este caso siempre hay que descartar
patología cerebral y no craneal. La fontanela anterior
es palpable al nacimiento, hundida o plana; debe valorarse
con el niño sentado, es común que se encuentre
abombada durante el llanto o en presencia de aumento patológico
de la presión intracraneal; su tamaño varía
entre 1 a 3 cms en su diámetro mayor, su cierre se
presenta entre los 10 y los 20 meses de edad. La fontanela
late sincrónicamente con el pulso. Al nacimiento
la fontanela posterior es puntiforme y se encuentra abierta
al nacimiento cuando se encuentra incremento de la presión
intracraneal, se cierra por completo a las 6 semanas de
vida. Un dato importante cuando se analiza a un niño
con macrocefalia o microcefalia, es medir el perímetro
cefálico de los padres, pues existen variantes familiares
normales. Una fontanela anterior amplia puede asociarse
con: acondroplasia, hipotiroidismo, prematuridad, hidrocefalia,
retardo del crecimiento intrauterino, osteogénesis
imperfecta, trisomía 13, 18 y 21 y los síndromes
de Apert, Silver-Russell y Kenny. Una fontanela tensa los
primeros días de vida, en un niño de término
asfixiado suele ser un signo de mal pronóstico y
suele representar edema cerebral grave.
-
Estado de alerta. Las
alteraciones de conciencia se identifican analizando los
periodos de alerta y sueño. Cuando el neonato está
alerta responde a estímulos externos como la voz
humana, el tacto, la luz. Los bebés que están
durmiendo son fácilmente despertados por estímulos
externos y los que lloran son fácilmente tranquilizados.
El estado de alerta es una de las funciones más sensibles
que depende de la integridad de los diferentes niveles del
sistema nervioso central. En el recién nacido el
estado de alerta es variable y depende de algunos factores
como la edad gestacional y el tiempo transcurrido después
de la última toma de alimento. A las 28 semanas de
gestación es difícil identificar periodos
de alerta, con la estimulación persistente se logra
apertura ocular y períodos de alerta durante algunos
segundos; a las 32 semanas de gestación presentan
apertura ocular espontánea, con movimientos de rotación
ocular y se pueden observar períodos de sueño-vigilia.
A las 37 semanas de gestación el llanto está
presente durante la vigilia; el recién nacido de
término permanece alerta durante períodos
de 30-90 minutos y responde a estímulos visuales,
auditivos y táctiles, el llanto es enérgico
y los períodos de sueño y de vigilia están
claramente delimitados. En el neonato asfixiado el estado
de alerta puede variar considerablemente, desde un estado
de hiperalerta con llanto persistente, irritabilidad y reducción
del sueño fisiológico, característico
de los primeras horas posteriores al evento asfíxico
hasta el deterioro progresivo con estado de coma, falta
de respuesta a estímulos y alteración del
patrón respiratorio, visto con frecuencia entre el
3-5º día posterior al evento asfíxico
y relacionado con un mal pronóstico funcional.
-
Exploración de los nervios
craneales. A las 26 semanas de gestación
el recién nacido parpadea frecuentemente en respuesta
a la luz, a las 32 semanas cierra los ojos mientras se esté
aplicando un estímulo luminoso y a las 37 semanas
dirigen la mirada hacia el estímulo luminoso. Para
valorar este nervio craneal deben observarse la pupilas
que deben ser simétricas con la misma respuesta a
estímulos visuales; la luz brillante hace que el
recién nacido parpadee o mantenga los ojos cerrados.
En la valoración del fondo de ojo se observa el disco
óptico más pálido que en los niños
mayores, la vascularización también es menor.
La pupila es de color blanco grisáceo. En el 20%
se observan hemorragias retinianas que no guardan relación
con complicaciones durante el parto ni con alteraciones
a nivel de sistema nervioso central o con secuelas neurológicas
y se resuelven completamente de 7 a 14 días. El análisis
detallado y la búsqueda de alteraciones retinianas
específicas asociadas con asfixia deben ser examinadas
de manera específica por un oftalmólogo infantil
con experiencia en la atención de neonatos prematuros
y asfixiados. En los recién nacidos prematuros la
maniobra de los ojos de muñeca que se obtiene rotando
suavemente la cabeza de un lado al otro ocasiona que la
mirada conjugada se desplace hacia el lado opuesto de la
rotación de la cabeza ayuda para la valoración
de los movimientos laterales de los ojos, sí la cabeza
se mueve en plano vertical se obtiene la misma respuesta
pero la dirección de la mirada es en sentido vertical.
La falta de movimiento de los ojos en la dirección
esperada traduce una alteración a nivel de los núcleos
a nivel de mesencéfalo o del trayecto de estos nervios.
La falta de abducción se relaciona con afectación
del VI nervio craneal o del músculo recto externo,
la falta de movimiento normal en dirección medial
implica afectación del III nervio craneal o del músculo
recto externo. En recién nacidos de término
también puede emplearse un objeto grande de color
llamativo como un círculo rojo o la cara del explorador,
el objeto de enfoque se mueve lentamente en el campo visual
del recién nacido. El nistagmo oculocinético
se presenta al pasar una banda con barras negras y blancas
en dirección horizontal en el campo visual, está
presente desde las 36 semanas de gestación. Debe
verificarse la amplitud de la hendidura palpebral la cuál
debe ser simétrica, de lo contrario indica ptosis
que puede ser secundaria a alteración del III nervio
craneal, debilidad del músculo elevador del párpado
superior por alteración en la placa neuromuscular
(miastenia gravis neonatal o transitoria), síndrome
de Horner (lesión de las fibras simpáticas
que suben por el plexo pericarotídeo por una fractura
de clavícula, trauma al momento del nacimiento, cirugía
torácica o venodisección o una alteración
del tejido conjuntivo palpebral. Las pupilas son difíciles
de valorar ya que los ojos se encuentran cerrados y se resisten
a la apertura forzada. El diámetro de la pupila en
los recién nacidos es de 3 a 4 mm, el reflejo fotomotor
se encuentra presente desde las 30 semanas de gestación
de manera inconstante y constante a partir de las 32 a 35
semanas. En neonatos asfixiados las pupilas suelen estar
dilatadas en las primeras horas de vida, representando un
predominio del tono aminérgico y el estado de stress,
aunque con el deterioro progresivo se puede observar mirada
desconjugada, pupilas pequeñas y sin respuesta a
la luz. Se debe explorar el reflejo corneal, que consiste
en que los ojos se cierran cuando la córnea es gentilmente
tocada con la punta de un cotonete. El nervio facial se
valora observando la movilidad de la cara así como
la amplitud y simetría de los movimientos faciales
espontáneos. Debe observarse la simetría de
la hendidura palpebral, la presencia bilateral de pliegues
frontales y nasogeneanos durante el llanto y la posición
de la comisura bucal. Hay que recordar que la boca se desvía
hacia el lado contrario de la parálisis facial y
que cuando se trata de una parálisis periférica
(intranuclear) se afecta también el cierre ocular
y el lado afectado es donde el paciente permanece con el
ojo abierto. Una parálisis bilateral sugiere siempre
un síndrome de Möbius, mientras que una parálisis
periférica sugiere una afección traumática
y una parálisis central (sin afección del
músculo orbicular de los párpados) sugiere
una afección de la corteza zona perisilviana o las
fibras piramidales que de ella emanan. A partir de las 28
semanas de gestación la función del nervio
auditivo se hace evidente al presentar respuesta a estímulos
sonoros. En la medida de que la maduración incrementa,
la respuesta es más evidente, dejando de realizar
actividad motora, cambio en el patrón respiratorio,
apertura de boca y de ojos. Para verificar la función
auditiva es necesario llevarlo a cabo cuando el recién
nacido se encuentra tranquilo, sin llanto, sin hambre y
asegurándose que los conductos auditivos se encuentran
permeables. Una de las secuelas mas frecuentes en pacientes
prematuros asfixiados es la pérdida auditiva, por
lo que es obligado verificar la integridad de la vía
auditiva mediante la realización de potenciales evocados
auditivos o emisiones otoacústicas. En la succión
intervienen el V, VII y XII nervios craneales y en la salivación
intervienen los nervios craneales IX, X y XII. La alimentación
implica la adecuada coordinación de la respiración,
la salivación y la succión. La succión
y la salivación se encuentran coordinadas de manera
adecuada desde las 28 semanas de gestación, pero
no así la respiración por lo que la alimentación
es poco coordinada a esta edad. A las 32 a 34 semanas de
gestación es cuando la respiración, succión
y salivación se encuentran integradas y coordinadas
para lograr una adecuada alimentación y hasta las
37 semanas de gestación se perfecciona esta función,
incluso en recién nacidos de término esta
coordinación no es perfecta hasta después
de las 48 horas de vida. Un retardo de la adquisición
de estas habilidades en neonatos con asfixia suele determinar
un mal pronóstico funcional para la alimentación
y mas tarde para el lenguaje, en una forma de parálisis
pseudobulbar, en la cual son los centros superiores (corticales)
de control quienes provocan una falla de la coordinación.
En el reflejo nauseoso participan los nervios craneales
IX y X, se valora con un abate-lenguas, ejerciendo presión
suave sobre la región posterior de la lengua, mediante
la estimulación de la úvula o de los músculos
posteriores de la faringe. El llanto también nos
permite evaluar el IX, X y XII nervios craneales, deben
valorarse el volumen y el tono del llanto; debemos tener
en cuenta que la alteración del llanto con mayor
frecuencia se debe a afección del sistema nervioso
central más que al periférico. El recién
nacido con depresión del sistema nervioso central
presenta un llanto débil y escaso. Durante un llanto
vigoroso es posible evaluar la simetría de la lengua
y el paladar del recién nacido. La presencia de fasciculaciones
puede indicar atrofia muscular medular, aunque su presencia
debe verificarse con el recién nacido tranquilo y
sin llorar.
-
Sistema motor. En la
función motora se valoran 4 parámetros que
son: tono, trofismo, fuerza y reflejos de estiramiento tendinoso.
En la exploración de estos parámetros debe
tomarse en cuenta la edad gestacional y la evaluación
debe efectuarse en recién nacidos mayores de 24 horas
de vida. El primer aspecto a evaluar es la postura en reposo
del recién nacido, así como la movilidad espontánea
de las extremidades. Mientras se evalúa el tono el
recién nacido debe estar en decúbito supino
con la cabeza en posición media, de modo que el reflejo
tónico del cuello no incremente el tono de manera
unilateral. Debe realizarse suspensión vertical para
determinar si el tono flexor de las extremidades es adecuado
y simétrico, ya que cuando existe hipotonía
el recién nacido en esta posición tiende a
deslizarse entre las manos del explorador. En la suspensión
ventral (maniobra de Landau) el recién nacido de
término adquiere una posición recta entre
el tronco y la cabeza, mientras que en presencia de hipertonía
de extensores del cuello, la cabeza suele superar al tronco.
La evaluación del tono también se realiza
con la aproximación del talón a la oreja,
de la mano hacia la oreja contralateral o mediante la medida
de los ángulos de flexión de algunas articulaciones
como la muñeca, tobillo o ángulo poplíteo.
La posición y el tono dependen de la edad gestacional
con una maduración de caudal a rostral, a las 28
semanas de gestación existe mínima resistencia
a la movilidad pasiva de todas las extremidades, a las 32
semanas predomina el tono flexor en las extremidades inferiores
y a las 36 semanas el tono flexor también es aparente
en las extremidades superiores; a la movilización
pasiva de las extremidades en recién nacidos de término
es evidente un tono flexor en las extremidades tanto superiores
como inferiores; la posición de la cabeza también
se encuentra influida por la edad gestacional, en recién
nacidos a término se encuentra de manera constante
desviada hacia la derecha y suele ser menos evidente durante
las primeras 24 hrs de vida. En neonatos asfixiados suele
identificarse inicialmente una hipotonía que provoca
que se reduzca la movilidad espontánea, las extremidades
suelen colgar en la maniobra de Landau y permanecen adheridas
a la cama cuando se encuentra en decúbito. En la
evaluación de la fuerza debe tomarse en cuenta los
movimientos de las extremidades, durante las primeras 4
semanas de vida predominan los movimientos de torsión,
de las 4 a las 12 semanas se caracterizan por inquietud
y nerviosismo, de las 8 a las 12 semanas predominan los
movimientos de mayor amplitud y fuerza. Ayuda el tomar las
manos o los pies y traccionar suavemente para medir la fuerza
que el neonato ejerce para llevar su mano a la posición
flexionada normal. Los reflejos de estiramiento muscular
evaluados en los recién nacidos son el pectoral,
bíceps, braquioradial, patelar y aquíleo.
Los reflejos se provocan con un martillo de reflejos acorde
al tamaño del neonato, se encuentran incrementados
y en ocasiones pueden estar ausentes en recién nacidos
sanos, aunque siempre son simétricos y el llanto
suele incrementarlos. La presencia de clonus del pie de
5 a 10 repeticiones se considera normal siempre y cuando
no exista ningún otro signo de alteración
neurológica durante el primero y segundo mes de vida,
después su presencia es patológica. La respuesta
plantar se extensora (al estimular la parte externa de la
planta del pié con una superficie roma, como un hisopo,
el neonato extiende los dedos y eleva el dedo mayor del
pié), debe ser simétrica, aunque ocasionalmente
es indiferente o flexora durante el llanto o el sueño.
La persistencia del reflejo plantar extensor después
de que el niño logra la deambulación (habitualmente
18 meses de edad) es anormal e indica alteración
de la vía cortico-espinal, al igual que una respuesta
francamente asimétrica y en especial cuando se asocia
con alteraciones de la fuerza y tono muscular. Un detalle
clínico importante de las lesiones córtico-espinales
neonatales es que los primeros días o semanas de
una lesión se asocian con hipotonía, mientras
que los primeros signos de espasticidad suelen aparecer
hasta semanas después.
-
Reflejos primarios neonatales.
REFLEJO DE MORO.- Se desencadena con la caída súbita
de la cabeza en relación con el tronco y consiste
en las aperturas de las manos, extensión y abducción
de las extremidades superiores acompañadas por un
grito. A las 28 semanas de gestación se encuentra
presente únicamente la apertura de las manos, a las
32 semanas está presente la abducción y la
extensión de las extremidades superiores y a las
37 semanas ya es evidente la flexión de las extremidades.
El reflejo de Moro desaparece a los 6 meses de edad. REFLEJO
DE PRENSION.- Está presente a partir de las 28 semanas
de gestación, es más fuerte a las 32 semanas
de gestación, consiste en cerrar la mano al estimular
la palma. Una mano empuñada asimétrica es
un dato de lesión córtico-espinal. RESPUESTA
TÓNICA DEL CUELLO.- Se desencadena rotando la cabeza
y consiste en la extensión de la extremidad superior
del lado en que se encuentra la cara, existe flexión
de la extremidad contralateral. El reflejo se encuentra
desde las 35 semanas de gestación, es más
evidente al mes de vida y desaparece entre los 6 y 7 meses
de edad. REFLEJO DE MARCHA.- Se encuentra desde las 37 semanas
de gestación, se desencadena al poner en contacto
la superficie plantar con la mesa.
-
Crisis convulsivas.
Las crisis convulsivas pueden ser una manifestación
de asfixia. Los eventos paroxísticos clínicos
asociados temporalmente con descargas epileptiformes y sincrónicas
en el EEG corresponden claramente a crisis convulsivas de
fisiopatología epiléptica; mientras que los
fenómenos clínicos no relacionados consistentemente
con descargas en el EEG pueden o no ser eventos convulsivos
verdaderos y podrían estar emparentados con movimientos
anormales o discinecias y corresponderían a paroxismos
de una fisiopatología diferente a la epiléptica
y por lo tanto su tratamiento con medicamentos antiepilépticos
sería cuestionable. Adicional a la correlación
clínico-electroencefalográfica, la información
de poder provocar o inhibir los movimientos mediante estímulos
es información importante para definir su fisiopatología
(aquellos fácilmente inhibidos con cambios posturales
y provocados por estímulos táctiles o auditivos
tienden a no ser crisis convulsivas de fisiopatología
epiléptica). Los principales tipos de crisis convulsivas
neonatales se resumen en el cuadro 7.
| Cuadro
7. Clasificación clínica de crisis
convulsivas
(Interacción
de las clasificaciones de Volpe 1995 y Mizrahi 1987) |
-
CRISIS SUTILES (Alteración paroxística
de la función neurológica).
-
Fenómenos Oculares
(parpadeo1-4,5, desviación
tónica de los ojos con o sin nistagmo1,4,5,
mirada fija2)
-
Movimientos oro-buco-linguales
(movimientos de masticación2,
muecas de llanto, succión5,
etc.)
-
Movimientos complejos
de miembros3
(pedaleo3, nadeo3,6,
mioclonías6)
-
Fenómenos autonómicos1-2
-
Apnea1-6
-
CRISIS CLÓNICAS (movimientos
rítmicos paroxísticos).
- Focales4
(restringidas a parte de un hemicuerpo o axiales)
- Multifocales4
(De forma migratoria no Jacksoniana, alternantes)
- Tónico-clónicas no generalizadas4
- CRISIS TÓNICAS (Contracción que
produce cambio postural paroxístico)
- Focales4 (afectan a una extremidad
o al tronco, no provocadas)
- Generalizadas3 provocadas por estímulos
sensoriales
(producen postura de descerebración)
- CRISIS MIOCLÓNICAS
(Contracciones bruscas, arrítmicas y predominan
en músculos flexores)
- Focales3,4. (afectan una extremidad
o músculos aislados)
- Multifocales3 (afectan de forma
sutil y migratoria diferentes
grupos musculares)
- Generalizadas4 (afectan extremidades
en forma simétrica o
músculos axiales).
|
| 1. Frecuente
en neonatos de término
2. Frecuente en neonatos prematuros
3. Sin correlación EEG y se duda que sean
crisis verdaderas
4. Con correlato EEG frecuente.
5. Frecuentemente asociadas con movimientos clónicos
o mioclónicos.
6. Puede o no correlacionarse con descargas en Video-EEG |
-
Clasificación de Sarnat.
Los doctores Sarnat y Sarnat analizaron las alteraciones neurológicas
que se encuentran en diversos grados de encefalopatía
hipóxica-isquémica y es así como crearon
una clasificación que es útil para establecer
el nivel de gravedad de la misma ( ver cuadro 8).
| Cuadro
8. Estadificación clínica de la encefalopatía
hipóxica isquémica |
| |
|
Leve |
Moderada |
Grave |
| FACTOR |
ESTADIO
I |
ESTADIO
II |
ESTADIO
III |
| Nivel de Conciencia |
Alerta |
Letárgico |
Coma |
| Tono muscular |
Normal |
Hipotonía |
Flacidez |
| Reflejos Tendinosos |
Hiperreflexia |
Hiperreflexia |
Reducidos ó
Ausentes |
| Mioclonías |
Presentes |
Presentes |
Ausentes |
| Reflejos Primarios |
|
|
|
| |
Succión |
Activa |
Deprimida |
Ausente |
| |
Moro |
Exagerado |
Incompleto |
Ausente |
| |
Prensión |
Normal-Exagerada |
Exagerada |
Ausente |
| |
Oculo-Cefálico |
Normal |
Hiper-reactivo |
Reducido/
Ausente |
| Función Autonómica |
|
|
|
| |
Pupilas |
Dilatadas |
Mióticas |
Variables/Fijas |
| |
Respiración |
Regular |
Variable en frecuencia |
Atáxica/Apnea |
| |
Frecuencia Cardiaca |
Normal/aumentada |
Bradicardia |
Bradicardia |
| Crisis Convulsivas |
Ausentes |
Frecuentes |
Infrecuentes |
| E.E.G. |
Normal |
Voltaje bajo/
Periódico/
Paroxístico |
Periódico/
Isoeléctrico |
| Sarnat HB, Sarnat MS. Arch
Neurol 1975; 33: 696-705. |
2. Daño orgánico múltiple.
El sistema cardiovascular se puede ver afectado durante la asfixia,
las manifestaciones pueden ser hipotensión grave, falta de
perfusión a tejidos con acidosis láctica importante,
insuficiencia cardiaca y cardiomegalia. Puede haber alteraciones
del ritmo. De igual manera, el riñón se puede ver
afectado y el paciente asfixiado puede presentar oliguria e hipervolemia.
Debido a esto es sumamente importante tener un cuidado especial
en el manejo de líquidos. En casos graves es inclusive necesario
realizar diálisis peritoneal. Otros órganos afectados
son el intestino que puede dar cuadros de enterocolitis necrosante
que puede tener una gravedad variable, pero que inclusive puede
llegar a la perforación.
VI. DIAGNÓSTICO
Para establecer el diagnóstico de asfixia se debe tener sospecha
de la misma, analizar antecedentes perinatales, realizar una buena
exploración neurológica y solicitar estudios de laboratorio
y gabinete adecuados.
1. Antecedentes perinatales.
Una buena historia de los sucesos que rodearon el curso del embarazo
es tan importante como las habilidades mismas para reconocer los
signos neurológicos en un neonato de riesgo. Una colección
de datos dirigidos a identificar la presencia de asfixia debe incluir
en el interrogatorio las enfermedades de la madre y complicaciones
durante el embarazo (diabetes gestacional, hipertensión asociada
a embarazo, preclampsia-eclampsia, enfermedades crónicas,
hemorragia transvaginal etc.), la presencia de malformaciones en
las dos familias (materna-paterna), la edad de los padres, el uso
de medicamentos y/o drogas, los resultados de los ultrasonidos realizados
durante la gestación, con especial cuidado de preguntar acerca
de anomalías estructurales. Es también muy importante
analizar el ritmo de crecimiento fetal (retardos del crecimiento
intrauterino asociados con insuficiencia placentaria son una causa
frecuente de asfixia intrauterina). Un punto importante de recordar
es que muchos neonatos con enfermedades neuro-musculares o con errores
innatos del metabolismo pueden nacer con pobre esfuerzo respiratorio
que precipita fenómenos asfíxicos por lo que siempre
se deben tener en mente para un diagnóstico adecuado de dichas
entidades. El periodo intraparto es fundamental para detectar datos
de sufrimiento fetal, se debe analizar tipo de monitorización
del feto, el tiempo de labor, complicaciones hemorrágicas
de la placenta, presencia de meconio, tipo de nacimiento (cesárea,
indicación, vaginal, fórceps etc.) Es importante preguntar
la calificación de Apgar (frecuencia cardiaca, esfuerzo respiratorio,
tono muscular, coloración y respuesta a estímulos)
al minuto y cinco minutos, y aunque ya se describieron los problemas
que tiene la misma para definir asfixia o secuelas neurológicas,
un puntaje de 3 o menos a los 5 minutos, es útil para el
diagnóstico, en conjunto con alteraciones clínicas
y con la presencia de acidosis, como se mencionó en la sección
de definición. Si el bebé nace muerto es indispensable
analizar la piel, en caso de no haber maceración es posible
que la muerte haya ocurrido durante el trabajo de parto y muy probablemente
por asfixia.
2. Criterios de asfixia.
Para establecer el diagnóstico de asfixia se debe estrictamente
cumplir con los criterios de la AAP y ACOG mencionados anteriormente;
sin embargo, como se explicó, esto es muy difícil
de realizar en la mayoría de los lugares donde los bebés
se asfixian. Se buscan alternativas para establecer el diagnóstico
de manera universal, sin embargo, todavía no se llega a un
acuerdo. Por ejemplo, la falta de llanto y respiración al
nacer, con bradicardia extrema o ausencia de pulsos y la presencia
de crisis convulsivas en las primeras 72 hrs podría apoyar
el diagnóstico clínico de asfixia, sin embargo, estas
definiciones se deben investigar de manera sistemática antes
de usarse de manera general. La asfixia se puede presentar con encefalopatía
aguda y con falla orgánica múltiple. A continuación
se presentan algunas consideraciones que ayudan a establecer el
diagnóstico de estas complicaciones.
-
La encefalopatía aguda neonatal.
Como se mencionó anteriormente, se puede presentar con
una constelación de signos y síntomas que aparecen
en horas o inclusive días. En general se detectan alteraciones
en la conciencia, tono, reflejos, alimentación, respiración
y o convulsiones. Siempre se debe hacer diagnóstico diferencial
con infecciones del sistema nervioso central, errores innatos
del metabolismo y hemorragia intracerebral. La encefalopatía
neonatal puede o no resultar en secuelas neurológicas
permanentes. Sin embargo, la parálisis cerebral asociada
a daño intraparto por hipoxia-isquemia solo se desarrolla
si el paciente tuvo encefalopatía.
-
Falla de otros órganos y
sistemas. En asfixia puede haber acidosis metabólica
importante por la falta de perfusión a tejidos y puede
haber alteraciones en la función de otros órganos,
como fue mencionado en sección previa.
3. Estudios de laboratorio.
En un paciente asfixiado se deben solicitar química sanguínea
con electrolitos, pruebas de función hepático, biometría
hemática, creatín fosfoquinasa fracción MB,
troponina, gasometrías de cordón umbilical y arteriales
seriadas. Si se sospecha un error innato del metabolismo se debe
solicitar amonio, ácidos orgánicos, tamiz ampliado
y otros estudios según sea la sospecha.
4. Estudios de gabinete.
-
Ultrasonido transfontanelar.
Entre las ventajas más señaladas de la ultrasonográfia
transfontanelar destacan: ser un medio no invasivo, portátil,
de bajo costo, sin uso de radiación, no requerir sedantes
para su realización y permitir el examen repetido del
cerebro en múltiples planos. Sin embargo, es importante
recordar que en algunas modalidades de patología intracraneal
como el edema cerebral, hemorragia subaracnoidea o subdural,
neoplasias y alteraciones de la mielinización las imágenes
de tomografía o de resonancia magnética son más
útiles. Los neonatos con encefalopatía hipóxico
isquémica pueden tener estudios de ultrasonografía
normales; sin embargo, los datos que se pueden observar son
pobre diferenciación entre la sustancia gris y blanca,
incremento en la ecogenicidad parenquimatosa y periventricular
sugestivo de edema cerebral difuso; la presencia de hiperecogenicidad
en ganglios básales y degeneración quística
de la sustancia blanca se interpreta como un hallazgo de mal
pronóstico funcional. En neonatos de pretérmino
se puede observar una ecogenicidad periventricular aumentada
que puede involucionar en pocos días o puede evolucionar
a desarrollar una leucomalacia periventricular microquística.
-
Tomografía cerebral computarizada
(TAC). La utilidad del estudio tomográfico en
asfixia es principalmente en la identificación de hipodensidad
del tejido cerebral entre el 2º y 4º día vida
(post-daño), el cual se ha asociado con un mal pronóstico
funcional.
-
Resonancia magnética.
Actualmente, se considera el estudio de elección para
el estudio de asfixia perinatal. Las lesiones son identificadas
más rápido que con la tomografía cerebral
Tabla 1.
VII. TRATAMIENTO
Es importante asegurar una buena ventilación y oxigenación.
Se debe tratar de tener gasometrías arteriales dentro de
lo normal, evitar hiperoxia e hipoxia, así como hipocarbia
y alcalosis, las últimas alteraciones pueden predisponer
a una disminución del flujo cerebral.
Se debe asegurar una buena circulación, perfusión
y presión arterial. Puede ser necesario administrar líquidos
y agentes inotrópicos. Es necesario realizar un ecocardiograma
para valorar la función miocárdica.
Es imprescindible asegurar que los niveles de glucosa, sodio
y calcio estén dentro de lo normal. Los niveles de glucosa
se deben monitorizar cada 2 horas hasta que se estabilicen y los
de sodio cada 12 hrs (el exceso de líquidos o la presencia
de complicaciones como secreción inapropiada de hormona
antidiurética puede dar lugar a hiponatremia). Es conveniente
administrar líquidos en volúmenes bajos normales
2-3 mL/Kg/hr (50-75 mL/Kg/día) de solución glucosada
al 10%, esto para evitar que por daño renal o por secreción
inadecuada de hormona antidiurética pueda haber hipervolemia.
Otro aspecto muy importante a vigilar es la temperatura, la
cual se debe mantener de 36.3 a 37.2C axilar. La hipertermia se
debe evitar ya que se ha asociado a pronósticos adversos.
El papel de la hipotermia terapéutica controlada en el
tratamiento de la asfixia se está actualmente investigando.
El bebé con asfixia no debe ser alimentado por 48 a 72
hrs debido a que el intestino pudo haber sido sometido a isquemia
importante. La alimentación debe empezarse hasta que haya
ruidos peristálticos, el abdomen esté blando y cuando
se haya descartado enterocolitis necrosante. De igual manera,
es necesario que el nivel de conciencia se haya recuperado y que
los reflejos protectores de la vía aérea (tos y
náusea) estén presentes.
En caso de que le bebé asfixiado presente convulsiones
es imprescindible checar los niveles de glucosa en sangre, si
éstos están por debajo de 47mg/dL se debe dar un
bolo de solución glucosada al 10% (2mL/Kg) y se debe iniciar
una infusión continua de solución glucosada al 10%
4ml/Kg/hora. Si los niveles de glucosa sanguínea son >
47mg/dL se debe administrar fenobarbital 20mg/kg intravenoso en
10 a 15 minutos. Este se puede repetir si no hay control de las
crisis convulsivas y si continúan puede ser necesario administrar
difenilhidantoína.
El fenobarbital solo está indicado cuando haya convulsiones,
no como profiláctico.
De igual manera, es necesario checar niveles de calcio, si hay
hipocalcemia se debe tratar.
Tratamiento experimental. Se estudia con mucho cuidado el papel
de la hipotermia, la cual principalmente se da en dos modalidades:
hipotermia generalizada y la hipotermia localizada a cabeza. Esta
debe administrarse en la ventana terapéutica que se ha
limitado a las primeras seis horas después del daño
asfíctico.
VIII. PREVENCIÓN
1. Intervención en periodo intra-parto.
Probablemente el periodo más importante para prevenir muertes
neonatales por asfixia sea el periodo intra-parto. La mayoría
de las muertes neonatales y maternas ocurren al momento del parto
o en los primeros días de vida. (22,23) Es indispensable
asegurar que las madres y sus hijos tengan un contacto temprano
con personal de salud entrenado, capaz de detectar complicaciones
y manejarlas adecuadamente o referirlas a centros especializados
en caso necesario.
A nivel mundial se ha calculado que del 5-7% de todos los recién
nacidos necesita algún tipo de intervención al momento
del parto y, lo que es muy interesante, hasta 70% de éstos
pueden ser identificados en el periodo prenatal. (24,25) Esta
cifra indica que en la mayoría de los nacimientos que puedan
tener problemas, se puede “anticipar” y preparar equipo
humano y tecnológico para resolver la situación
crítica. Sin embargo, el resto dependerá de la capacitación
de la persona que atiende el parto y de su habilidad para resolver
situaciones de emergencia.
En el mundo, solo 56% de los partos son atendidos por personal
capacitado, en México esta cifra es mayor y alcanza casi
el 90% (26); sin embargo, dentro del país aún existen
comunidades donde la mayoría de los partos son atendidos
por “parteras”. Es importante entonces también
capacitarlas. Es necesario prever y prevenir situaciones que puedan
causar asfixia y evitar retardo en: identificación del
problema, búsqueda de atención y resolución.
Algunas necesidades especiales para este período son:
-
Monitorización fetal, que permitirá
detectar oportunamente sufrimiento fetal.
-
Programas de reanimación y estabilización
neonatal. Es indispensable entrenar personal en programas reconocidos
en reanimación neonatal como el programa de la Academia
Americana de Pediatría y de la Asociación Americana
del Corazón. En México este programa se ha difundido
desde la década de los 90´s. Sin embargo, es también
necesario entrenar en la estabilización inmediata del
neonato de una manera sistematizada y que incluya todas las
áreas en las que puede haber problemas, para lo que se
está trabajando también con la difusión
de programas como el curso de ACoRN (por sus siglas en inglés:
Acute Care of at Risk Newborns, cuidado agudo de recién
nacidos en riesgo). Los gineco-obstetras tienen un papel muy
importante con el reconocimiento y tratamiento de urgencia de
condiciones que pongan en peligro la vida del feto/recién
nacido y de la madre.
-
Pinzamiento tardío del cordón
umbilical. Se ha estudiado el papel que el pinzamiento tardío
de cordón umbilical (30 a 120 segundos después
del nacimiento) tiene en neonatos pretérmino y término.
En los primeros y en lugares que no cuentan con unidades de
cuidado intensivo neonatal ni bancos de sangre, el pinzamiento
tardío podría representar una oportunidad para
no necesitar en algunos casos, volumen o cristaloides, ya que
con esta medida los neonatos pueden recibir hasta 30 a 150 ml
extras de sangre. (27) Se ha reportado que la estabilización
posnatal es mejor en pacientes pretérmino
con pinzamiento tardío de cordón que en aquellos
sin esta medida. (28,29) Sin embargo, el papel que el pinzamiento
tardío de cordón tiene en manejo de asfixia establecida
ó en neonatos que requieren reanimación es aun
controvertido y necesita más investigación. En
recién nacidos a término, el principal beneficio
del pinzamiento tardío del cordón es la menor
incidencia de anemia en los primeros meses de vida. (30-31)
2. Otros periodos relevantes de intervención.
Para disminuir muertes neonatales por asfixia es importante entender
todos los periodos de tiempo relevantes para la intervención,
que incluyen, además del periodo intra-parto mencionado anteriormente,
- Salud pre-embarazo
- Cuidados durante el embarazo
- Cuidados del recién nacido (rutina y emergencia)
La salud pre-embarazo promoverá una buena
nutrición en la mujer en edad reproductiva y una vida sana
al evitar tabaquismo u otras drogas nocivas; estas medidas pueden
evitar el bajo peso del neonato, accidentes placentarios, etc.,
e indirectamente disminuir asfixia. La mayoría de los eventos
que originan asfixia ocurren in-útero; debido a
esto es importante tener buen cuidado prenatal para identificar
problemas que se pueden asociar a asfixia; por ejemplo, problemas
de hipertensión asociada a embarazo, retardo en el crecimiento
intra-uterino, problemas de placenta, etc.
- 1. Las muertes maternas y perinatales pueden ser evitadas por
intervenciones costo-efectivas y accesibles. Los pronósticos
de los neonatos están íntimamente relacionados a
la salud materna y se ha calculado que el 70% de las muertes fetales
y neonatales pueden prevenirse por intervenciones maternas. (32)
IX. PRONÓSTICO
Afortunadamente, no todos los pacientes con encefalopatía
isquémica neonatal desarrollan secuelas a largo plazo. Las
posibles secuelas a largo plazo incluyen desde déficit motores
leves hasta cuadriplejia espástica con o sin alteraciones
del movimiento, convulsiones, alteraciones cognoscitivas, alteraciones
neurosensoriales y problemas con la alimentación.
Es muy importante determinar que grado de encefalopatía
tiene cada paciente asfixiado (ver cuadro clínico) ya que
los grados leves tienen pronósticos normales; en contraste,
los que tienen alteraciones graves o mueren o quedan con secuelas
graves neurológicas a largo plazo. Los pacientes con grados
moderados de encefalopatía casi siempre sobreviven, pero
hasta el 30% pueden tener secuelas a largo plazo. (ACORN). Otros
datos de mal pronóstico neurológico son: presencia
de crisis convulsivas persistentes o de difícil control;
exploración neurológica anormal más allá
de una semana de vida; dificultad en alimentación que requiera
sonda nasogástrica por periodos prolongados.
Recientemente se explora el papel que los estudios
de imagen como la resonancia magnética cerebral puedan tener
en establecer pronósticos a largo plazo (inder)
X. PLANTEAMIENTOS PARA LA ATENCIÓN
Y SOLUCIÓN DEL PROBLEMA DE SALUD EN EL NIVEL NACIONAL
1. Necesidad de información.
Es imprescindible crear estrategias para mejorar el pronóstico
neonatal y fetal. El primer paso para lograr este objetivo es tener
información “útil” sobre la mortalidad
perinatal en todas las regiones de México y esto incluye
la asfixia. Es necesario determinar qué población
tiene el mejor pronóstico perinatal mediante la comparación
con el resto de las poblaciones e identificar los excesos de muertes
que pueden ser prevenibles si todos los embarazos tuvieran las mismas
oportunidades que la población con el mejor pronóstico
reproductivo en nuestro país. Con esta estrategia se identifican
las áreas que necesitan mayor intervención para mejorar
pronósticos reproductivos. No se pueden crear estrategias
si no se conocen los problemas.
Actualmente, se tiene un sistema de registro de
estadísticas vitales. El INEGI lleva el control de los nacimientos
que se registran cuando los padres acuden a tramitar el acta de
nacimiento de sus hijos a las oficinas del Registro Civil, sin embargo,
esta información carece de integridad y de oportunidad debido
al subregistro y al registro extemporáneo. Por ello es que
se requiere de una estadística confiable, completa y oportuna
sobre los nacimientos ocurridos en el país que nos permita
contar con datos de la madre, del recién nacido, del lugar
de ocurrencia, de la persona que atiende el parto y de quien lo
certifica. En este sentido surgió la iniciativa de establecer
un Certificado de Nacimiento. En 2003 la Secretaría de Salud
a través de la Dirección General de Información
en Salud (DGIS) elaboró un formato de registro de nacimientos
consensuado con varias instituciones del Sector Salud en el que
se recaba información de la madre, del recién nacido
y del nacimiento, así como de la persona que lo certifica.
Con esto hemos tenido un gran avance y se espera que toda la República
utilice estos certificados.
Desgraciadamente en el momento actual en México
no hay una “liga” o conexión entre el certificado
de nacimiento y el de defunción. Esto no permite establecer
mortalidad específica por peso al nacimiento, lo cual es
indispensable para conocer la problemática y crear estrategias
de intervención. Es por esto que es necesario establecer
un sistema de vigilancia perinatal confiable y sistematizado, con
un sistema de análisis de información basado en el
peso y la edad a la muerte y que permita establecer comparaciones
para identificar áreas con exceso de mortalidad.
El peso al nacimiento es un importante predictor
de muerte neonatal. Es también claro que a menor peso y edad
gestacional hay mayor necesidad de reanimación neonatal y
mayor riesgo de asfixia. La edad a la muerte es muy importante ya
que permite identificar en qué momento de la vida sucede
la muerte. Por ejemplo, si en una población ocurre un exceso
de muertes al nacer, seguramente es por la presencia de mayor número
de casos de asfixia; por lo tanto, se deberá analizar la
monitorización del parto, el reconocimiento del sufrimiento
fetal y la adecuada y oportuna intervención de los obstetras
y pediatras/neonatólogos. Si por el contrario ocurre en los
primeros 7 días de vida, además de analizar lo anterior,
se deberá checar control de temperatura, infecciones, nutrición,
etc.
2. Abordaje por sistemas para un problema
multifactorial.
Las muertes perinatales resultan de una compleja interacción
de factores médicos y sociales. No existe una intervención
ÚNICA que pueda resolver el problema, por lo que el abordaje
incluye “sistemas” en los que intervienen:
- El sector informal y la comunidad: Esto incluye familias, población,
parteras.
- El sistema formal de salud: Todas las instituciones de salud,
privadas o públicas.
- El sistema intersectorial: Incluye los sistemas que indirectamente
intervienen en salud, como por ejemplo la educación, el
sistema de transporte, etc.
El sector informal y la comunidad son un importante
objetivo para disminuir muertes por asfixia. En México aproximadamente
90% de los partos ocurren en instituciones (26), el resto se lleva
a cabo en domicilios. Proyectos piloto han demostrado que entrenar
a parteras en reanimación neonatal disminuye el número
de muertes por asfixia. De igual manera, un metanálisis también
demostró que esta medida mejoró la sobrevida perinatal
y disminuyó muertes por asfixia. (33-36) También,
se debe entrenar a familias a reconocer emergencias obstétricas,
y a acudir oportunamente a unidades para buscar atención.
El sistema formal de salud es básico. Es
importante asegurar calidad adecuada en la atención médica.
Se deben revisar estructuras, procesos y resultados. Actualmente,
existen programas de reanimación neonatal, de manejo del
neonato de alto riesgo (ACoRN), de estabilización al recién
nacido, etc., los cuales deben difundirse entre el personal encargado
de atender partos. Es importante que las autoridades en salud supervisen
dicho entrenamiento. El obstetra debe ser capaz de reconocer y tratar
emergencias, y esto incluye la realización de cesáreas
de emergencia cuando esté indicado, la disponibilidad de
sangre, el manejo y reconocimiento de crisis hipertensivas, etc.
Debe promoverse comunicación estrecha entre ginecólogos,
pediatras y neonatólogos y crear guías de manejo perinatal
resultado de un consenso entre ellos.
El sistema intersectorial es también importante,
garantizar medios de traslado y caminos para aquellas comunidades
aisladas permitirá a madres llegar a unidades de atención
adecuadas. Este sistema es particularmente necesario en regiones
rurales de México. Sin embargo, aún en grandes ciudades
es indispensable organizar un sistema de transporte para las madres
y neonatos de alto riesgo, que permita conducir a éstos a
centros especializados; sin esta medida será imposible abatir
la mortalidad neonatal.
3. Un esfuerzo global para evitar la asfixia.
Una gran proporción de casos de asfixia se pueden identificar
y tratar oportunamente. Existen, sin embargo, algunos que son difíciles
de prevenir o prever, por ejemplo problemas agudos del cordón
umbilical. En estas situaciones, la madre puede notar disminución
o falta de movimientos fetales, que generalmente significan que
el daño neurológico de su hijo ya ocurrió.
Estas situaciones son por ahora poco predecibles y son difíciles
de prevenir.
4. Colaboración internacional para
disminuir muertes perinatales por asfixia.
Debemos tener como una prioridad nacional y mundial, la necesidad
de investigar estrategias para PREVENIR Y TRATAR oportunamente la
asfixia perinatal. Esta necesidad ha sido identificada por autoridades
a nivel mundial y es así como se ha creado dentro del Programa
para Investigación Pediátrica Global (Programme for
Global Paediatric Research “PGPR”), un equipo para analizar
la “crisis global” este grave problema de salud pública.
El equipo está formado por un grupo representante de Salvando
la Vida de Recién Nacidos (Saving Newborn Lives); el Instituto
Nacional Estadounidense de Salud y Desarrollo del Niño (the
American National Institute of Child Health and Development); la
Organización Mundial de la Salud (the World Health Organization);
la Asociación Internacional Pediátrica (the International
Pediatric Association); la Red Neonatal Canadiense (Canadian Neonatal
Network), miembros de diversas sociedades pediátricas del
mundo y otras asociaciones o instituciones (como el Hospital Infantil
de México) más. Las principales conclusiones a las
que se ha llegado son:
-
Es necesario tener una definición
universal de asfixia. Se debe recordar que no todos los lugares
de nacimiento tienen la facilidad de tomar gasometrías
para detector acidez del feto o recién nacido
-
Se deben crear estrategias para evitar la
asfixia intrauterina y la muerte fetal
-
Es imperativo tratar oportunamente la asfixia
neonatal, para lo que se debe capacitar al personal que se dedica
a atender partos.
-
Es necesario hacer seguimiento a largo plazo
de los problemas neurológicos de la asfixia.
-
Se deben implementar registros para medir
“fielmente” el problema: su prevalencia, factores
de riesgo, efectos a corto y largo plazo, etc.
-
Es necesario mantener comunicación
estrecha entre todos los trabajadores de salud, unir esfuerzos
y crear estrategias para disminuir o evitar la asfixia perinatal.
XI. COMENTARIO
La asfixia puede traer como consecuencia un número importante
de muertes, sin embargo, también deja un número similar
de sobrevivientes con secuelas a largo plazo. Debido a esto, debemos
reforzar nuestro sistema de vigilancia, no solo para capturar muertes
por asfixia sino también secuelas en los sobrevivientes.
La asfixia perinatal es un problema importante
de salud pública en el mundo. En México es responsable
de la mayoría de las muertes neonatales. Desgraciadamente,
no se ha visto, en las últimas tres décadas, una disminución
importante en la mortalidad por esa causa en nuestro país
ni en otros países en desarrollo. Para lograr disminuir la
mortalidad infantil es indispensable crear estrategias para prevenir
la asfixia perinatal, mediante la identificación y tratamiento
oportuno de condiciones que afecten el bienestar fetal. Investigadores,
clínicos, epidemiólogos, gineco-obstetras y neonatólogos
de todo el mundo debemos unir esfuerzos para abordar, prevenir y
tratar oportunamente la asfixia perinatal y para llevar un registro
fiel de este problema y sus secuelas.
Debemos analizar cuidadosamente este aspecto de
salud pública y planear estrategias de intervención
para lograr mejorar la sobrevida y calidad de vida de los recién
nacidos y poder así cumplir con la Meta Global número
4 del Milenio: disminuir a dos terceras partes la mortalidad
en menores de cinco años, del año 1990 al
año 2015.
REFERENCIAS
-
Best practices: detecting and treating newborn
asphyxia. Baltimore, MD, JHPIEGO, 2004.: http://www.mnh.jhpiego.org/best/detasphyxia.pdf.
Octubre 20, 2005.
-
Lawn JE, Cousen S, Zupan J, for the Lancet
Neonatal Survival Steering Team. Acceso en. http://www.activemag.co.uk/lancet.htm
Octubre 20, 2005.
-
World Health Organization. The World Health
Report. Shaping the Future. Geneve: World Health Organization
2003. disponible en: http://www.who/int/whr/en/.
-
Wiggleswoth JS. Monitoring perinatal mortality.
A pathophysiological approach. Lancet 1980;2:684-6.
-
Ellis M, Manandhar DS, Manandhar N, Wyatt
J, Bolam AJ, Costello AM. Stillbirths and neonatal encephalopathy
in Kathmandu, Nepal: an estimate of the contribution of birth
asphyxia to perinatal mortality in a low-income urban population.
Paediatr Perinat Epidemiol 2000;14:39-52.
-
Lawn J, Shibuya K, Stein C. No cry at birth:
global estimates of intrapartum stillbirths and intrapartum-related
neonatal deaths. Bull World Health Organ 2005; 8:409-17.
-
Lawn JE, Cousens S, Zupan J; Lancet Neonatal
Survival Steering Team.4 million neonatal deaths: when? Where?
Why? Lancet. 2005;365:891-900.
-
World Health Organization. Essential new
born care: Report of a technical working group. Geneva: WHO;
1996.
5. Vandale SL, Kageyama M, Rascon-Pacheco RA. Time-trends and
causes of infant, neonatal and postneonatal mortality in Mexico,
1980-1990. Salud Pública Méx 1997; 39: 48-52.
-
Darmstadt G, Lawn J, Costello A. Advancing
the state of the world’s newborns. Bull World Health Organ.
2003;81:224–225
-
Bhutta Z, De Silva H, Awasthi S, et al.
Maternal and child health: is
South Asia ready for change? Br Med J. 2004;328:816–819
-
Parlato R, Darmstadt G, Tinker A. Planning
and Using Qualitative Research to Improve Newborn Care Practices:
A Guide for Program Managers. Washington, DC: Saving Newborn
Lives, Save the Children/USA; 2004.
-
Batool Azra Haider and Zulfiqar A. Bhutta
Birth Asphyxia in Developing Countries: Current Status and Public
Health Implications Curr Probl Pediatr Adolescent Health Care
2006;36:178-188.
-
Casey B, McIntyre D, Leveno KJ. The continuing
value of the Apgar score for the assessment of newborn infants.
N Engl J Med 2001;344:467-7
-
Apgar Score and Neonatal Mortality. the
Collaborative Neonatal Health Study Group (Neosano)s Experience
in Mexico. Looking Through the Eyes of Virginia. Erika Galvan-Bautista,
Monica Villa-Guillen, Maria Teresa Murguia-de Sierra, Grupo
Neosano. Neonatology, Hospital Infantil de Mexico Federico Gomez,
Mexico City, DF, Mexico; Neonatal Health Study Group, Mexico.PAS2005:57:2415.
-
Catlin EA, Carpenter MW, Brann BS 4th, Mayfield
SR, Shaul PW, Goldstein M, Oh W.The Apgar score revisited: influence
of gestational age. .J Pediatr1986; 109:865-8.
-
Committee on Fetus and Newborn, American
Academy of Pediatrics, and Committee on Obstetric Practice,
American College of Obstetricians and Gynecologists. Use and
abuse of the Apgar score. Pediatrics 1996;98:141-2.
-
American Academy of Pediatrics and American
College of Obstetricians and Gynecologists. Care of the neonate.
Guidelines for perinatal care. Gilstrap LC, Oh W, editors. Elk
Grove Village (IL): American Academy of Pediatrics; 2002: 196-7.
-
Crowley P, Chalmers I, Keirse MJNC. The
effects of corticosteroid administration before preterm delivery:
An overview of the evidence from controlled trials. Br J Obstet
Gynaecol 1990;97:11-25
-
Jobe AH, Mitchell BR, Gunkel JH. Beneficial
effects of the combined use of prenatal corticosteroids and
postnatal surfactant on preterm infants. Am J Obstet Gynecol
1993;168:508-13.
-
White AD, Andrews EB, Weinberg JM, et al.
The Exosurf Neonatal TIND Study Group. Factors associated with
intraventricular hemorrhage (IVH) in the exosurf neonatal treatment
IND (TIND). Pediatr Res1992;31:263A.
-
Piña Pérez PK, Murguía
de Sierra T. Mortalidad del Recién Nacido con peso Menor
o Igual a 1500g en la Unidad de Cuidados Intensivos del Hospital
Infantil de México Federico Gómez. Tesis Neonatología
2004.
-
Save the Children. The State of the World's
Newborns. Washington, DC: Save the Children Fund, 2001.
-
Hill, K. “Reducing Perinatal and Neonatal
Mortality.” Child Health Research Project Special Report,
Vol 3, No 1. Report of a meeting. Baltimore, May 10-12, 1999.
-
Primhak RA, Herber SM, Whincup G, Milner
RDG. Which deliveries require pediatricians in attendance? Br
Med J 1984;289:16-18.
-
World Health Organization, Child Health
and Development: health of the newborn. Geneva, Switzerland:
World Health Organization; 1991.
-
Acceso en: http://www.salud.gob.mx. Octubre
20, 2005.
-
Mercer JS. Current best evidence: a review
of the literature on umbilical cord clamping. J Midwifery Womens
Health 2001;46:402– 14.
-
Mercer JS, McGrath MM, Hensman A, et al.
Immediate and delayed cord clamping in infants born between
24 and 32 weeks: a pilot randomized controlled trial. J Perinatol
2003;23:466–72.
-
Ibrahim HM, Krouskop RW, Lewis DF, et al.
Placental transfusion: umbilical cord clamping and preterm infants.
J Perinatol 2000;20:351–4. ]
-
Grajeda R, Perez-Escamilla R, Dewey K. Delayed
clamping of the umbilical cord improves hematologic status of
Guatemalan infants at 2 mo of age. Am J Clin Nutr 1997;65:425–31.
31. Geethanath RM, Ramji S, Thirupuram S, et al. Effect of timing
of cord clamping on the iron status of infants at 3 months.
Indian Pediatr 1997;34:103– 6.
-
Lawn J, McCarthy B, Rae Ross S. The Healthy
Newborn. A Reference Manual for Program Managers. CDC, CCHI,
The Health Unit Care.
-
Kumar R. Training traditional birth attendants
for resuscitation of newborns. Trop Doct 1995; 25:29–
30.
-
Kumar R. Effect of training on the resuscitation
practices of traditional birth attendants. Trans R Soc Trop
Med Hyg 1994;88:159–60.
-
Kumar R. Birth asphyxia in a rural community
of north India. J Trop Pediatr 1995;41:5– 7.
-
Sibley L, Sipe TAM. What can a meta-analysis
tell us about traditional birth attendant training and pregnancy
outcomes? Midwifery 2004;20:51–60.
|


