Sibutramina
Cápsulas
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada CÁPSULA contiene:
Clorhidrato de sibutramina monohidratada................ 10 y 15 mg
Excipiente, c.b.p. 1 cápsula.
INDICACIONES TERAPÉUTICAS: Inhibidores de recaptura de noradrenalina, serotonina y dopamina
para el tratamiento de la obesidad y del sobrepeso, incluyendo pérdida de
peso y su mantenimiento, cuando esté indicado médicamente, en conjunción con
una dieta baja en calorías; como son pacientes obesos con un índice de masa
corporal inicial ³ 30 kg/m2 o ³
27 kg/m2 en presencia de otros facto-
res de riesgo (ejemplo: hipertensión arterial, diabetes, dislipidemias). SIBUTRAMINA
debe emplearse como parte de un programa integral de control de peso que incluya
dieta, ejercicio y cambios en el estilo de vida.
CONTRAINDICACIONES: Antecedentes o presencia de alteraciones mayores en el comer.
Hipersensibilidad conocida a SIBUTRAMINA o a cualquiera de los componentes del producto.
Uso concomitante de inhibidores de la monoaminooxidasa (IMAOs). Debe permitirse un intervalo de por lo menos dos semanas después de la discontinuación de los IMAOs antes de empezar la terapia con SIBUTRAMINA (véase Interacciones medicamentosas y de otro género).
Uso concomitante de otros agentes para reducción de peso de acción central.
PRECAUCIONES GENERALES:
Advertencias:
Presión arterial y frecuencia cardiaca: El tratamiento con SIBUTRAMINA se ha asociado a aumentos en la frecuencia cardiaca y/o de presión arterial. La presión arterial y la frecuencia cardiaca deben monitorearse previo al inicio de la terapia y a intervalos regulares en pacientes con SIBUTRAMINA. En pacientes que experimenten aumentos sostenidos clínicamente significativos, la dosis de SIBUTRAMINA debe disminuirse o debe descontinuarse el tratamiento. SIBUTRAMINA debe administrarse con precaución a pacientes con hipertensión inadecuadamente controlada.
Enfermedad cardiovascular concomitante: Hay potencial de aumentos en la frecuencia cardiaca y/o la presión arterial. De esta forma, SIBUTRAMINA no debe utilizarse en pacientes con antecedentes de enfermedad arterial coronaria, insuficiencia cardiaca congestiva, arritmias o evento vascular cerebral (EVC).
Glaucoma: SIBUTRAMINA debe utilizarse con precaución en pacientes con glaucoma de ángulo cerrado.
Misceláneos: Deben excluirse las causas orgánicas de obesidad (por ejemplo, hipotiroidismo no tratado), antes de prescribir SIBUTRAMINA.
Precauciones:
Epilepsia: SIBUTRAMINA debe administrarse con precaución a pacientes con epilepsia.
Hipertensión pulmonar: Aunque no se ha asociado SIBUTRAMINA con hipertensión pulmonar, ciertos agentes para pérdida de peso de acción central, que causan liberación de serotonina de las terminaciones nerviosas (un mecanismo de acción diferente al de SIBUTRAMINA), se han asociado a hipertensión pulmonar, una enfermedad rara, pero mortal. No se han reportado casos de hipertensión pulmonar en los estudios clínicos precomercialización con cápsulas de SIBUTRAMINA.
Insuficiencia renal: SIBUTRAMINA debe utilizarse con precaución en pacientes con insuficiencia renal leve a moderada. SIBUTRAMINA no debe utilizarse en pacientes con insuficiencia renal severa, incluyendo insuficiencia renal terminal en diálisis.
Insuficiencia hepática: Los pacientes con insuficiencia hepática severa no se han estudiado sistemáticamente; por lo tanto, SIBUTRAMINA no debe utilizarse en dichos pacientes.
Alteraciones hemorrágicas: Ha habido reportes de sangrado en pacientes tomando SIBUTRAMINA. Mientras que una relación causal no sea clara, se recomienda precaución en pacientes predispuestos a eventos de sangrado y en aquellos tomando medicaciones concomitantes conocidas de afectar la hemostasis o la función plaquetaria.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Categoría de embarazo: C.
Mientras que los estudios sobre reproducción en animales han mostrado que SIBUTRAMINA no es teratogénico, la seguridad de SIBUTRAMINA durante el embarazo no se ha establecido y, por lo tanto, no se recomienda su uso durante el embarazo. Las mujeres fértiles deben utilizar un método adecuado de anticoncepción mientras tomen SIBUTRAMINA.
Lactancia: No se sabe si la SIBUTRAMINA se excreta en la leche materna; por lo tanto, no se recomienda la administración del fármaco durante la lactancia.
REACCIONES SECUNDARIAS Y ADVERSAS:
Reacciones durante los estudios clínicos: La mayoría de los efectos colaterales reportados con SIBUTRAMINA ocurrieron al inicio del tratamiento en frecuencia, como en severidad. Por lo general, fueron reversibles, no fueron serios y no implicaron discontinuación del tratamiento.
Los efectos secundarios observados en los estudios clínicos fases II/III se enlistan a continuación, por sistema corporal (muy comunes > 1/10; y £ 1/10 y > 1/100):
Cardiovascular: Comunes: taquicardia, palpitaciones, aumento de la presión arterial/hipertensión y vasodilatación.
Gastrointestinal: Muy común: constipación; comunes: náusea y agravamiento de hemorroides.
Sistema nervioso central: Muy comunes: sequedad de boca e insomnio; comunes: sensación de aturdimiento, parestesia, cefalea y ansiedad.
Piel: Común: sudación.
Funciones sensoriales: Común: alteración del sentido del gusto.
Hipertensión y
aumento de la frecuencia cardiaca en estudios clínicos: Se han observado aumentos en las presiones arterial sistólica y diastólica
en repo-
so en el rango de 1-3 mmHg y de la frecuencia cardiaca, de 3-5 latidos por
minuto. En relación al placebo, un pequeño número de pacientes experimentó
aumentos sostenidos en la presión arterial y en la frecuencia cardiaca en
reposo. Han sido raros los eventos adversos relevantes que se asociaron con
aumentos en la presión arterial y en la frecuencia cardiaca durante el tratamiento
con SIBUTRAMINA, y ocurrieron con incidencia parecidas a aquellos observados
en los pacientes en placebo, durante los estudios controlados con placebo.
Reacciones en los estudios de vigilancia postcomercialización y fase IV: Los eventos adversos clínicamente significativos adicionales observados durante estudios clínicos y vigilancia postcomercialización, se enlistan por sistema corporal:
Alteraciones en los sistemas hemático y linfático: Trombocitopenia.
Alteraciones en el sistema inmune: Se han reportado reacciones alérgicas de hipersensiblidad, desde erupciones cutáneas leves y urticaria, hasta angioedema y anafilaxia.
Alteraciones psiquiátricas: En pacientes bajo tratamiento con SIBUTRAMINA, se han reportado casos de depresión, ideación suicida y suicidio. Sin embargo, no se ha establecido relación causal alguna entre la ocurrencia de depresión y/o ideación suicida y el uso de SIBUTRAMINA. Si ocurre depresión durante el tratamiento con SIBUTRAMINA, puede ser necesaria la evaluación posterior.
Alteraciones del sistema nervioso: Crisis convulsivas y alteración transitoria de la memoria a corto plazo.
Alteraciones oculares: Visión borrosa.
Alteraciones cardiacas: Fibrilación auricular.
Alteraciones gastrointestinales: Diarrea y vómito.
Alteraciones de la piel y el tejido subcutáneo: Alopecia, rash y urticaria.
Alteraciones renales y urinarias: Nefritis intersticial aguda y retención urinaria.
Alteraciones del sistema reproductor: Eyaculación/orgasmos anormales, disfunción eréctil, alteraciones del ciclo menstrual y metrorragia.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
Medicamentos activos en el sistema nervioso central (SNC): No se ha evaluado sistemáticamente el uso de cápsulas de SIBUTRAMINA en combinación con otros fármacos activos en el SNC, particularmente agentes serotoninérgicos. Consecuentemente, se aconseja precaución si está indicada la administración concomitante de SIBUTRAMINA con otros medicamentos de acción central.
Inhibidores de la monoaminooxidasa (IMAOs): Está contraindicado el uso de SIBUTRAMINA con inhibidores de la monoaminooxidasa (IMAOs): Debe permitirse un intervalo de por lo menos dos semanas después de la discontinuación de los IMAOs antes de empezar la terapia con SIBUTRAMINA (véase Contraindicaciones).
Síndrome serotoninérgico: La rara, pero seria, constelación sintomática llamada síndrome serotoninérgico, se ha reportado con el uso concomitante de inhibidores selectivos de la recaptura de serotonina y agentes antimigrañosos. El síndrome serotoninérgico también se ha reportado con el uso concomitante de dos inhibidores de la recaptura de serotonina.
Ya que SIBUTRAMINA inhibe la recaptura de serotonina, no debe administrarse con otros agentes serotoninérgicos. Sin emgargo, si está indicada clínicamente dicha combinación, es obligada la apropiada observación del paciente.
Medicamentos que pueden aumentar la presión arterial o la frecuencia cardiaca: No se ha evaluado sistemáticamente el uso concomitante de SIBUTRAMINA con otros fármacos que pueden elevar la presión arterial o la frecuencia cardiaca. Estos agentes incluyen ciertos descongestivos, medicaciones para la tos, el resfrío o para la alergia que contienen agentes como epinefrina o pseudoefedrina. Debe tenerse precaución cuando se prescriba SIBUTRAMINA a pacientes que utilizan estos medicamentos.
Medicamentos que inhiben el metabolismo de citocromo P-450 (3A4): La coadministración de inhibidores enzimáticos, con ketoconazol, eritromicina y cimetidina, puede aumentar las concentraciones plasmáticas de SIBUTRAMINA. Debe tenerse precaución sobre la administración concomitante de SIBUTRAMINA con otros inhibidores enzimáticos.
Anticonceptivos orales: SIBUTRAMINA no afecta la eficacia de los medicamentos anticonceptivos orales.
Alcohol: A dosis únicas, no hay alteración adicional del desempeño cognitivo o psicomotor cuando se administra SIBUTRAMINA concomitantemente con alcohol. Sin embargo, no se recomienda el uso concomitante de SIBUTRAMINA con alcohol en exceso.
ALTERACIONES EN LOS RESULTADOS DE PRUEBAS DE LABORATORIO: Aumento reversible de las enzimas hepáticas.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD: No hay evidencia de mutagénesis inducida por SIBUTRAMINA en sistemas in vitro ni en animales de experimentación. No hay evidencia de carcinogénesis en ratas y ratones hembras. No hay evidencia de teratogénesis en ratas y conejos. No se han detectado alteraciones de la fertilidad en modelos animales.
DOSIS Y VÍA DE ADMINISTRACIÓN: Oral.
Pacientes con sobrepeso y padecimientos concomitantes, una cápsula de 10 mg por un periodo de 6 a 24 meses.
Pacientes obesos con o sin padecimientos concomitantes, una cápsula de 15 mg por un periodo de 6 a 24 meses.
Se recomienda que los pacientes con sobrepeso y padecimientos concomitantes que no hayan perdido 2 kg o más durante el primer mes de tratamiento y que no hayan experimentado eventos adversos, aumenten la dosis a 15 mg.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL: Hay experiencia limitada sobre la SIBUTRAMINA. Los eventos adversos más frecuentemente notados asociados con su sobredosis son: taquicardia, hipertensión, cefalea y mareo. El tratamiento debe consistir en medidas generales utilizadas para el manejo de las sobredosis, como establecimiento de la vía aérea cuando sea necesario, monitoreo de los signos cardiacos y vitales y medidas generales sintomáticas y de apoyo. Los resultados de un estudio en pacientes con insuficiencia renal terminal en diálisis, mostró que, mediante hemodiálisis, los metabolitos de SIBUTRAMINA no se eliminan en grado significativo.
RECOMENDACIONES SOBRE ALMACENAMIENTO: Consérvese a temperatura ambiente, a no más de 25°C y en lugar seco. Protéjase del calor, de la humedad y de la luz.
LEYENDAS DE PROTECCIÓN:
Literatura exclusiva para médicos. Su venta
requiere receta médica.
No se deje al alcance de los niños.
NOMBRE Y DOMICILIO DEL LABORATORIO:
Véase Presentación o Presentaciones.
PRESENTACIÓN O PRESENTACIONES:
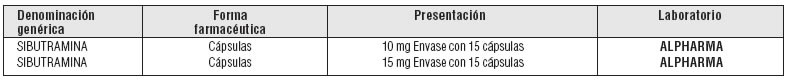
Fuente: S.S.A. Catálogo
de Medicamentos Genéricos Intercambiables para farmacias y público en general
al 3 de agosto de 2007.
Con el objeto de demostrar la intercambiabilidad a que se refiere el artículo
75 del reglamento de Insumos para la Salud, los medicamentos que integran
el Catálogo de Medicamentos Genéricos Intercambiables han sido comparados,
siguiendo los lineamientos indicados por la NOM-177SSA1-1998,
contra los productos innovadores o de referencia enlistados en las págs.
11 a 22 donde usted lo podrá consultar.