Metronidazol
Solución inyectable, suspensión
y tabletas vaginales
Anaerobicida, amebicida
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada 100 ml de SOLUCIÓN INYECTABLE contienen:
Metronidazol.................................................................... 500 mg
Cada 10 ml de SOLUCIÓN INYECTABLE contienen:
Metronidazol.................................................................... 200 mg
Cada 100 ml de SUSPENSIÓN contienen:
Metronidazol..................................................................... 2.5 mg
Vehículo, c.b.p. 100 ml.
Cada TABLETA vaginal contiene:
Metronidazol.................................................................... 500 mg
Excipiente, c.b.p. 1 tableta.
INDICACIONES TERAPÉUTICAS:
METRONIDAZOL vía parenteral está indicado en: Tricomonicida, giardicida, amebicida.
Infecciones ginecológicas como endometritis, abscesos tubo-ováricos, salpingitis.
Infecciones del tracto respiratorio inferior como empiema, abscesos pulmonares, neumonía producidos por Bacteroides sp.
Septicemia bacteriana,
Endocarditis causada por Bacteroides sp.
Tratamiento de infecciones bacterianas graves por anaerobios susceptibles (infecciones aeróbicas y anaeróbicas mixtas, se podrá utilizar conjuntamente con un antimicrobiano para la infección aeróbica. Es eficaz en infecciones por Bacteroides fragilis, resistente a la clindamicina, cloranfenicol y penicilina).
Infecciones intra-abdominales, peritonitis, abscesos intraabdominales, abscesos hepáticos, causados por Bacteroides sp, incluyendo el grupo de B. fragilis (B. fragilis, B. distasonis, B. ovatus, B. vulgatus), Clostridium sp, Eubacterium sp, Peptococcus niger y Peptostreptococcus sp.
Profilaxis de infecciones postoperatorias, especialmente en cirugía colorrectal o contaminada. Indicado para el tratamiento de amebiasis intestinal o extraintestinal, incluyendo absceso hepático amebiano causado por Entamoeba Histolytica.
Tabletas vaginales: Como tratamiento de la vaginosis bacteriana causada por Gardnerella vaginalis.
CONTRAINDICACIONES:
Hipersensibilidad a los compuestos imidazol, primer trimestre del embarazo, antecedentes de discracias sanguíneas o con padecimiento activo del SNC.
PRECAUCIONES GENERALES:
Se han reportado crisis convulsivas y neuropatía periférica en pacientes tratados con METRONIDAZOL; la aparición de cualquier signo neurológico anormal requiere de una evaluación cuidadosa de la relación riesgo-beneficio.
Se debe advertir a los pacientes que no deben consumir bebidas alcohólicas durante el tratamiento con METRONIDAZOL, y por lo menos un día después de finalizado el tratamiento, debido a la posibilidad de que aparezca una reacción tipo disulfiram (efecto Antabuse).
Los pacientes con alteraciones hepáticas severas pueden metabolizar METRONIDAZOL más lentamente que el resto de la población, lo que los coloca en riesgo de acumulación del medicamento y sus metabolitos en plasma.
En este tipo de pacientes se recomienda usar dosis menores. Se recomienda vigilar la cuenta de leucocitos total y diferencial antes y después del tratamiento con METRONIDAZOL, en especial en los pacientes con antecedentes de discrasias sanguíneas.
Los pacientes deben ser prevenidos sobre la posibilidad de que se presente confusión, vértigo, alucinaciones convulsiones trastornos visuales transitorios, para que si se presentan estos síntomas eviten conducir vehículos u operar maquinaria.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y LA LACTANCIA:
Categoría de riesgo B: METRONIDAZOL cruza la barrera placentaria y entra rápidamente a la circulación fetal.
Sin embargo, los estudios realizados en ratones a los que se administró METRONIDAZOL vía intraperitoneal, sí mostraron efectos fetotóxicos. Además, METRONIDAZOL es claramente carcinogénico en roedores.
METRONIDAZOL se excreta en la leche materna y alcanza concentraciones similares a las observadas en el plasma.
Debido al conocido efecto mutagénico del mismo, debe decidirse si se continuará con la lactancia o con el medicamento, dependiendo de la importancia de la indicación original.
REACCIONES SECUNDARIAS Y ADVERSAS:
Las reacciones más graves reportadas con el uso de METRONIDAZOL incluyen convulsiones y neuropatía periférica. Otras reacciones reportadas son:
Tracto gastrointestinal: Dolor epigástrico, náusea, vómito, alteraciones gastrointestinales, diarrea y sabor metálico.
Hematopoyético: Neutropenia reversible y trombocitopenia.
Piel: Erupciones, eritema y prurito. Fiebre, angioedema.
SNC: Cefalea, mareo, síncope, ataxia y confusión. Estos síntomas pueden interferir con la habilidad para conducir o utilizar maquinaria peligrosa.
Trastornos visuales: Diplopía y miopía transitorias.
Reacciones locales: Flebitis en el sitio de infusión I.V.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
Disulfiram: Se ha reportado que la combinación de disulfiram y METRONIDAZOL puede causar reacciones psicóticas.
Alcohol: La ingestión de alcohol durante el tratamiento con METRONIDAZOL puede causar cólicos, náusea, cefalea y alteraciones vasomotoras.
Terapia anticoagulante oral: METRONIDAZOL potencia el efecto anticoagulante de la warfarina y otros anticoagulantes cumarínicos, causando un alargamiento del tiempo de protrombina.
Fenitoína o Fenobarbital: La administración de medicamentos que inducen enzimas microsomales como la fenitoína y el fenobarbital pueden causar una disminución en los niveles plasmáticos de METRONIDAZOL. Por el contrario, la administración de medicamentos que disminuyen la actividad enzimática del sistema microsomal pueden alargar la vida media del METRONIDAZOL y reducir su depuración plasmática.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS, MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE LA FERTILIDAD:
METRONIDAZOL es carcinogénico en ratas y ratones, pero no se ha observado un aumento en la incidencia de tumores en los estudios epidemiológicos realizados hasta el momento.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Suspensión:
Amebiasis:
Adultos: 1.5 g/día divididos en tres dosis.
Niños: 30 a 40 mg/kg/día divididos en tres dosis.
En caso de absceso hepático amebiano, se debe realizar drenaje o aspiración del pus en conjunción con la terapia con metronidazol.
El curso del tratamiento es por 7 días consecutivos.
Tricomoniasis:
Mujeres (uretritis y vaginitis): 2 g administrados como dosis única (4 tabletas de METRONIDAZOL de 500 mg) o durante 10 días de tratamiento, combinando 500 mg/día por vía oral divididos en dos dosis y un óvulo/día.
Las parejas sexuales deben ser tratadas simultáneamente, aun si están asintomáticas o tienen un cultivo negativo de Trichomonas vaginalis.
Hombres (uretritis): 2 g administrados por vía oral como única dosis, o un tratamiento de 10 días consistente en 500 mg de METRONIDAZOL divididos en dos dosis.
En muy raros casos, puede ser necesario aumentar la dosis a 750 mg o 1 g.
Giardiasis: Tratamiento por 5 días.
Adultos: 750 mg a 1 g por día.
Niños:
2 a 5 años: 250 mg/día (1 tableta de 250 mg de
METRONIDAZOL o 1 cucharadita de
5 ml de suspensión de 250 mg o 2
cucharaditas de 5 ml de suspensión de 125 mg).
5 a 10 años: 375 mg/día (1½ tableta de 250 mg de METRONIDAZOL o 1½ cucharadita de 5 ml de suspensión de 250 mg o 3 cucharaditas de 5 ml de suspensión de 125 mg).
10 a 15 años: 500 mg/día (2 tabletas de 250 mg de METRONIDAZOL o 2 cucharaditas de 5 ml de suspensión de 250 mg o 4 cucharaditas de 5 ml de suspensión de 125 mg).
Vaginitis no específica: 500 mg dos veces al día durante 7 días consecutivos.
La pareja sexual debe ser tratada simultáneamente.
Tabletas vaginales:
En la vaginosis bacteriana por Gardnerella vaginalis y en la vaginitis por Trichomona vaginalis:
Por vía vaginal una tableta de 500 mg cada 12 horas por cinco días.
Tratamiento de infecciones anaeróbicas: (Como terapia de primera línea o de seguimiento).
Adultos: 1 a 1.5 g/día.
Niños: 20 a 30 mg/día.
Profilaxis de infecciones quirúrgicas: Los antecedentes científicos no permiten la definición de un protocolo ideal.
El METRONIDAZOL debe ser administrado concomitantemente con terapia antibiótica efectiva contra enterobacterias.
La administración de 500 mg cada 8 horas, empezando aproximadamente 48 horas antes de la cirugía, parece ser efectiva.
La última dosis debe ser administrada mínimo 12 horas antes de la cirugía. Dado que la profilaxis de infección quirúrgica está encaminada para reducir el inóculo bacteriano en el tracto gastrointestinal al momento de la cirugía, la administración postoperatoria de antibióticos es innecesaria, al menos oralmente.
Niños: El mismo protocolo a una dosis de 20 a 30 mg/kg/día.
Solución inyectable:
Parenteral: Para el tratamiento de las infecciones por anaerobios se recomienda iniciar con una dosis de carga de 15 mg/kg I.V., administrados durante una hora.
La dosis de mantenimiento debe ser de 7.5 mg/kg I.V., administrados durante una hora cada 6 horas.
Para la profilaxis quirúrgica se puede utilizar una dosis de 15 mg/kg I.V., administrados durante una hora y terminando la infusión una hora antes de la cirugía, seguidos de 7.5 mg/kg I.V., administrados durante 30 a 60 minutos 6 y 12 horas después del procedimiento.
MANIFESTACIONES Y MANEJO DE LA SOBREDOSIFICACIÓN O INGESTA ACCIDENTAL:
Se han reportado con dosis única oral de 12 g intentos de suicidio y por sobredosificación accidental. Los síntomas estuvieron limitados a náusea, vómito, ataxia y desorientación leve.
Además se han reportado casos de sobredosis con METRONIDAZOL I.V. (de hasta 75 mg/kg/dosis de carga) seguido de la dosis de mantenimiento usual, sin que se presentaran efectos secundarios.
Como no existe un tratamiento específico, en caso de sobredosificación se deben instituir las medidas de apoyo convencionales.
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Consérvese a temperatura ambiente a no más de 30° C y en lugar seco.
LEYENDAS DE PROTECCIÓN:
Literatura exclusiva para médicos. Su
venta requiere receta médica.
No se deje al alcance de los niños. El empleo de este medicamento
durante el embarazo es responsabilidad del médico tratante.
No se administre simultáneamente con bebidas alcohólicas.
NOMBRE Y DOMICILIO DEL LABORATORIO:
Véase Presentación o Presentaciones.
PRESENTACIÓN O PRESENTACIONES:
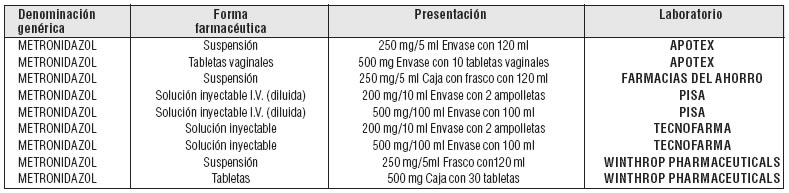
Fuente: S.S.A. Catálogo de Medicamentos Genéricos Intercambiables para
farmacias y público en general al 3 de agosto de 2007.
Con el objeto de demostrar la intercambiabilidad a que se refiere el artículo
75 del reglamento de Insumos para la Salud, los medicamentos que integran
el Catálogo de Medicamentos Genéricos Intercambiables han sido comparados,
siguiendo los lineamientos indicados por la NOM-177SSA1-1998,
contra los productos innovadores o de referencia enlistados en las págs. 11 a
22 donde usted lo podrá consultar.