Cefepima
Solución inyectable
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada frasco ámpula con SOLUCIÓN INYECTABLE contiene:
Clorhidrato monohidratado
de cefepima equivalente a....................................... 500 mg,
de cefepima
Excipiente, c.b.p.
Cada ampolleta con diluyente contiene:
Agua inyectable........................................................ 3, 5 y 10 ml
INDICACIONES TERAPÉUTICAS:
Adultos: CEFEPIMA está indicado en los adultos para el tratamiento de las infecciones que aparecen a continuación cuando son causadas por bacterias susceptibles:
Infecciones de las vías respiratorias bajas, incluyendo neumonía y bronquitis.
Infecciones de las vías urinarias complicadas y no complicadas, incluyendo pielonefritis.
Infecciones de la piel y anexos.
Infecciones intraabdominales, incluyendo peritonitis e infecciones de las vías biliares.
Infecciones ginecológicas.
Septicemia.
Tratamiento empírico de la neutropenia febril.
Profilaxis en cirugía abdominal.
Uso pediátrico: CEFEPIMA está indicado en pacientes pediátricos para el tratamiento de las infecciones que aparecen a continuación cuando son causadas por bacterias susceptibles:
Neumonía.
Infecciones de las vías urinarias complicadas y no complicadas, incluyendo pielonefritis.
Infecciones de la piel y anexos.
Septicemia.
Tratamiento empírico de la neutropenia febril.
Meningitis bacteriana.
Los estudios de cultivo y sensibilidad deben realizarse cuando resulte apropiado determinar la sensibilidad a CEFEPIMA de los microorganismos causantes.
La terapia empírica con CEFEPIMA puede instituirse antes de conocer los resultados de las pruebas de sensibilidad; sin embargo, una vez que los resultados estén disponibles, el tratamiento con antibióticos debe ajustarse de acuerdo con éstos. Debido a su amplio espectro de actividad bactericida contra bacterias grampositivas y gramnegativas, CEFEPIMA puede utilizarse como monoterapia antes de identificar el microorganismo o microorganismos causantes.
En los pacientes con riesgo de infección mixta por microorganismos aerobios y anaerobios, particularmente si existen bacterias insensibles a CEFEPIMA, se recomienda la terapia inicial concurrente con un agente antianaerobio antes de identificar los microorganismos causantes.
Cuando dichos resultados estén disponibles, se determinará si se requiere o no una terapia combinada con CEFEPIMA y otros agentes antimicrobianos, dependiendo del perfil de sensibilidad.
CONTRAINDICACIONES:
CEFEPIMA está contraindicado en los pacientes que han tenido reacciones anteriores de hipersensibilidad a alguno de los componentes de la preparación, a los antibióticos de la clase de las cefalosporinas, a la penicilina o a otros antibióticos betalactámicos.
PRECAUCIONES GENERALES:
Los antibióticos deben administrarse con precaución a los pacientes que hayan demostrado alguna clase de alergia, particularmente a fármacos. Si llegara a ocurrir alguna reacción alérgica a CEFEPIMA, deberá suspenderse su administración y tratar al paciente apropiadamente.
Las reacciones serias de hipersensibilidad pueden requerir epinefrina y otra terapia de apoyo. Se ha reportado colitis seudomembranosa prácticamente con todos los antibióticos de espectro amplio, incluyendo CEFEPIMA; por lo tanto, es importante considerar dicho diagnóstico en los pacientes que desarrollan diarrea asociada al uso de antibióticos. Los casos leves de colitis pueden responder a la sola interrupción del fármaco; los casos moderados a severos podrían requerir un tratamiento más complejo.
En los pacientes con insuficiencia renal, como reducción del flujo urinario por insuficiencia renal (depuración de creatinina < 50 ml/min), u otras situaciones que comprometan el funcionamiento renal, la dosis de CEFEPIMA debe ajustarse para compensar la menor velocidad de eliminación renal. La dosis de mantenimiento debe reducirse en estos pacientes, debido a que pueden presentarse concentraciones elevadas y prolongadas del medicamento.
La administración continua debe ser determinada por el grado de daño renal y la severidad de la infección, así como por la susceptibilidad del organismo causal (véase Dosis y vía de administración). Durante los estudios de vigilancia posmercadeo han sido reportados los siguientes eventos adversos serios: encefalopatía reversible (alteración de la conciencia, incluyendo confusión, alucinaciones, estupor y coma), mioclonos, convulsiones (incluyendo estado epiléptico no convulsivo) e insuficiencia renal.
La mayoría de los casos ocurrieron en pacientes con daño renal, quienes recibieron dosis de CEFEPIMA superiores a las recomendadas. En general, los síntomas de neurotoxicidad se resolvieron después de suspender la administración de CEFEPIMA y/o después de la hemodiálisis. Sin embargo, algunos casos incluyeron un resultado fatal.
Debe vigilarse cuidadosamente la función renal si se administran simultáneamente con CEFEPIMA medicamentos con potencial nefrotóxico, como los aminoglucósidos y diuréticos potentes.
Como con otros antibióticos, el uso de CEFEPIMA puede causar sobrecrecimiento de organismos no susceptibles.
Durante la terapia puede ocurrir superinfección, por lo que deberán tomarse las medidas necesarias.
Uso geriátrico: De más de 6,400 pacientes adultos tratados con CEFEPIMA en estudios
clínicos, 35% tenían 65 años o más y 16% tenían 75 años o más. En
los estudios clínicos en los que se administró la dosis usual recomendada
para adultos a pacientes geriátricos, la seguridad y la eficacia clínica del
medicamento fueron comparables a las observadas en los pacientes adultos no
geriátricos a menos que los pacientes tuvieran insuficiencia renal.
Se registró una prolongación modesta en la vida media de eliminación y una reducción de los valores de la depuración renal en comparación con los observados en pacientes más jóvenes. Se recomienda ajustar la dosis si la función renal se encuentra comprometida (véase Dosis y vía de administración). Se sabe que CEFEPIMA es eliminado principalmente vía renal y el riesgo de toxicidad es mayor en pacientes con insuficiencia renal.
En el caso de los pacientes geriátricos es más probable que exista una disminución de la función renal, por lo tanto, ésta debe vigilarse y adecuar la dosis del medicamento (véase Precauciones generales, Reacciones secundarias y adversas). Se han reportado los siguientes eventos adversos serios en pacientes geriátricos con insuficiencia renal, que recibían la dosis usual de CEFEPIMA: encefalopatía reversible (alteraciones de la conciencia incluyendo confusión, alucinaciones, estupor y coma), mioclonos, convulsiones (incluyendo estado epiléptico no convulsivo) e insuficiencia renal.
Capacidad para conducir/uso de maquinaria: No se ha estudiado el efecto de CEFEPIMA sobre la capacidad para conducir y el uso de maquinaria.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y
No se ha demostrado daño fetal en los estudios de reproducción realizados en ratones, ratas y conejos; sin embargo, no se han llevado a cabo estudios adecuados y bien controlados en mujeres embarazadas.
Debido a que los estudios de reproducción en animales no siempre pueden pronosticar la respuesta humana, este fármaco sólo debe utilizarse durante el embarazo cuando sea claramente necesario.
Lactancia: CEFEPIMA se excreta en la leche materna en concentraciones muy bajas.
La administración de CEFEPIMA a madres lactantes debe efectuarse con precaución.
REACCIONES SECUNDARIAS Y ADVERSAS:
Generalmente CEFEPIMA es bien tolerado. En los estudios clínicos (n = 5,598) los eventos adversos más comunes fueron: síntomas gastrointestinales y reacciones de hipersensibilidad. A continuación aparece una lista de los efectos adversos considerados como definitiva, probable o posiblemente relacionados con CEFEPIMA.
Los eventos que ocurrieron con una incidencia de > 0.1%-1% (excepto cuando se indica otra cifra) fueron:
Hipersensibilidad: Erupción cutánea (1.8%), prurito, urticaria.
Eventos gastrointestinales: Náusea, vómito, candidiasis oral, diarrea (1.2%), colitis (incluyendo colitis seudomembranosa).
Sistema nervioso central: Cefalea.
Otros: Fiebre, vaginitis, eritema.
Los eventos que ocurrieron con una incidencia de 0.05%
a 0.1% fueron: dolor abdominal, estreñimiento, vasodilatación, disnea,
vértigo, parestesia, prurito genital, alteraciones del sentido del gusto,
escalofrío y candidiasis no específica. Los eventos clínicamente significativos
que ocurrieron con una incidencia de
< 0.05% incluyeron anafilaxis y convulsiones.
Ocurrieron reacciones locales en el sitio de la infusión I.V. en 5.2% de los pacientes; éstas incluyeron flebitis (2.9%) e inflamación (0.1%). La administración intramuscular de CEFEPIMA fue muy bien tolerada, ya que sólo 2.6% de los pacientes experimentaron inflamación o dolor en el sitio de la inyección.
El perfil de seguridad de CEFEPIMA en bebés y niños es similar al observado en adultos.
El efecto reportado con mayor frecuencia en los estudios clínicos que se consideró relacionado con CEFEPIMA fue la erupción cutánea.
Experiencia posmercadeo: En adición a los eventos reportados durante los estudios clínicos de Norteamérica con CEFEPIMA, las siguientes experiencias adversas han sido reportadas duante los estudios mundiales posmercadeo. En vista del origen no controlado de esos reportes espontáneos, no ha sido determinada una relación causal con CEFEPIMA. Como con algunos otros medicamentos de su clase, han sido reportados: encefalopatías (alteraciones de la conciencia, incluyendo confusión, alucinación, estupor y coma), convulsiones, mioclono y/o insuficiencia renal.
La mayoría de los casos han ocurrido en pacientes con daño renal quienes recibieron dosis de CEFEPIMA, que excedieron las recomendaciones (véase Precauciones generales).
Se han reportado los siguientes eventos adversos y alteraciones de las pruebas de laboratorio para los antibióticos de la clase de las cefalosporinas: síndrome de Stevens-Johnson, eritema multiforme, necrólisis epidérmica tóxica, nefropatía tóxica, anemia aplásica, anemia hemolítica, hemorragia y pruebas falsas-positivas para la glucosa urinaria. Como con otras cefalosporinas han sido reportados anafilaxis, incluyendo shock anafiláctico, leucopenia transitoria, agranulocitosis y trombocitopenia.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO: Las soluciones de CEFEPIMA al igual que la mayoría de los antibióticos betalactámicos, no deben añadirse a soluciones de metronidazol, vancomicina, gentamicina, sulfato de tobramicina, ni sulfato de netilmicina, debido a una interacción potencial.
Sin embargo, si el tratamiento concomitante con CEFEPIMA está indicado, cada uno de estos antibióticos puede administrarse por separado.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS,
MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE
No se han realizado estudios a largo plazo en animales para evaluar el potencial carcinogénico. Las pruebas de genotoxicidad in vitro e in vivo han demostrado que CEFEPIMA no es genotóxico. No se han observado alteraciones de la fertilidad en ratas.
DOSIS Y VÍA DE ADMINISTRACIÓN:
CEFEPIMA puede administrarse por vía intravenosa o intramuscular.
La dosis y la vía de administración varían según la sensibilidad del microorganismo causante, la severidad de la infección, la función renal y la condición general del paciente.
Adultos y pacientes pediátricos > 40 kg: La tabla 1 muestra las recomendaciones para la dosificación de CEFEPIMA en pacientes adultos y pediátricos con una función renal normal.
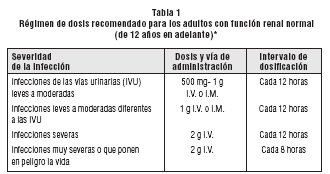
* La duración usual de la terapia es
de
Pacientes pediátricos con función renal normal: De 1 mes de nacidos hasta los 12 años, con función renal normal.
Dosis usuales recomendadas: Neumonía, infecciones de las vías urinarias e infecciones de la piel y anexos.
Pacientes > 2 meses de edad con un peso £ 40 kg: 50 mg/kg cada 12 horas durante 10 días.
Para el tratamiento de infecciones más severas puede utilizarse un régimen de administración cada 8 horas.
Septicemia, meningitis bacteriana y tratamiento empírico de la neutropenia febril:
Pacientes >
2 meses de edad con un peso £
40 kg: 50 mg/kg cada 8 horas durante
La experiencia con el uso de CEFEPIMA en pacientes pediátricos < 2 meses es limitada.
Aunque dicha experiencia se ha obtenido utilizando la
dosis de 50 mg/kg, los modelos de datos farmacocinéticos obtenidos en pacientes
> 2 meses de edad sugieren que puede considerarse la administración de
una dosis de 30 mg/kg cada 12 horas o cada 8 horas en pacientes de
La dosis tanto de 50 mg/kg para pacientes mayores de 2
meses como la dosis de 30 mg/kg para pacientes entre 1 y 2 meses de edad,
son comparables a la dosis de
La administración de CEFEPIMA en dichos pacientes debe monitorearse cuidadosamente.
Para los pacientes
pediátricos con un peso > 40 kg: Se aplican las dosis recomendadas para adultos (véase tabla 1).
Las dosis en los pacientes pediátricos no deben exceder la dosis máxima recomendada
en adultos (
Pacientes con insuficiencia renal: En pacientes con función renal alterada, la dosis de CEFEPIMA debe ser ajustada para compensar la menor velocidad de eliminación renal.
La dosis inicial de CEFEPIMA en pacientes con alteración renal moderada es la misma que se administra a los pacientes con función renal normal.
La tabla 2 muestra las dosis de mantenimiento de CEFEPIMA recomendadas en los pacientes adultos con insuficiencia renal.
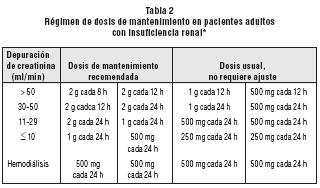
* Modelos farmacocinéticos indican que
es necesario reducir la dosis en estos pacientes. A los pacientes en hemodiálisis
que reciben CEFEPIMA, ésta debe administrarse de la siguiente forma:
Cuando se dispone de sólo una medición de la creatinina sérica, puede utilizarse la siguiente fórmula (ecuación de Cockcroft y Gault) para calcular la depuración de creatinina. La creatinina sérica debe representar un estado estable de la función renal:

Pacientes en diálisis: En los pacientes sometidos a hemodiálisis, aproximadamente 68% de
la cantidad total de CEFEPIMA presente en el organismo al iniciar la diálisis
será eliminado en un periodo de 3 horas de diálisis. En los pacientes sometidos
a diálisis peritoneal continua ambulatoria, CEFEPIMA debe administrarse a
las dosis recomendadas para pacientes con función renal normal, es decir,
500 mg, 1 ó
Niños con insuficiencia renal: Ya que la excreción urinaria es la ruta de eliminación primaria
de CEFEPIMA en los pacientes pediátricos, debe considerarse un ajuste de la
dosis de CEFEPIMA en los pacientes < 12 años de edad con insuficiencia
renal. Una dosis de 50 mg/kg en los pacientes de 2 meses hasta 12 años de
edad, y una dosis de 30 mg/kg en los pacientes de
Cuando sólo se dispone del valor de la creatinina sérica, la depuración de creatinina debe estimarse utilizando cualquiera de los siguientes métodos:

Insuficiencia hepática: En los pacientes con insuficiencia hepática no se requiere un ajuste de la dosis.
Profilaxis en cirugía abdominal (adultos):
La dosis recomendada en profilaxis para prevenir infecciones en pacientes
sometidos a cirugía abdominal es la siguiente: 60 minutos antes de iniciar
la cirugía se debe administrar una dosis de
de 500 mg de metronidazol I.V. La dosis de metronidazol debe ser preparada
y administrada de acuerdo a las indicaciones oficiales para este producto.
Debido a la incompatibilidad, CEFEPIMA y metronidazol no deben ser mezclados
en el mismo contenedor.
Se recomienda drenar la línea intravenosa con un fluido compatible antes de la infusión del metronidazol. Si el procedimiento quirúrgico durara más de 12 horas, se recomienda una segunda administración de ambos productos 12 horas después de la administración inicial.
Preparación y administración de las soluciones: El polvo de CEFEPIMA se reconstituye utilizando los volúmenes de diluyentes que se especifican en la tabla 3; después de la tabla se describen los diluyentes que deben utilizarse.

Administración intravenosa (I.V.): La vía de administración intravenosa es recomendable para los pacientes
con infecciones severas o que ponen en peligro la vida, particularmente si
existe la posibilidad de choque. Para la administración intravenosa directa,
CEFEPIMA debe reconstituirse con agua inyectable estéril, con inyección de
dextrosa al 5%, o con solución salina al 0.9% utilizando los volúmenes de
diluyentes descritos en la tabla 3. La solución resultante debe inyectarse
directamente en la vena en un periodo de
Para la infusión I.V., el frasco ámpula de 500 mg, 1 ó
Administración intramuscular (I.M.):
CEFEPIMA debe reconstituirse con uno de los siguientes diluyentes utilizando
los volúmenes que se especifican en la tabla 3: agua inyectable estéril, solución
salina al 0.9%, dextrosa al 5% o agua inyectable bacteriostática con parabenos
o alcohol bencílico, y administrarse mediante inyección intramuscular profunda
en una masa muscular grande (como el cuadrante superior externo del glúteo
mayor). En un estudio farmacocinético, se administraron dosis hasta de
Aunque CEFEPIMA puede reconstituirse con clorhidrato de lidocaína al 0.5% o al 1.0%, generalmente no es necesario, ya que CEFEPIMA produce poco dolor, o bien, no produce dolor en absoluto después de la administración I.M.
Compatibilidad y estabilidad:
Administración
intravenosa: CEFEPIMA es compatible a concentraciones
de
de lactato de sodio M/6, solución de dextrosa al 5% e inyección de solu-
ción salina al 0.9%, solución de Ringer lactato e inyección de dextrosa al
5%. Dichas soluciones son estables hasta por 24 horas a temperatura ambiente
o durante 7 días bajo refrigeración.
La tabla 4 muestra un resumen de la información sobre compatibilidad y estabilidad para combinar CEFEPIMA.

Las soluciones de CEFEPIMA, al igual que la mayoría de los antibióticos betalactámicos, no deben combinarse con soluciones que contengan metronidazol, vancomicina, gentamicina, sulfato de tobramicina o sulfato de netilmicina, ya que son física o químicamente incompatibles. Sin embargo, cada uno de estos antibióticos puede administrarse por separado cuando está indicado un tratamiento concomitante con CEFEPIMA.
Inyección intramuscular: CEFEPIMA reconstituido según las especificaciones (que aparecen en la tabla 3) es estable por 24 horas a temperatura ambiente o por 7 días bajo refrigeración utilizando los siguientes diluyentes: agua inyectable estéril, solución salina al 0.9%, inyección de dextrosa al 5%, agua inyectable bacteriostática con parabenos o alcohol bencílico, o clorhidrato de lidocaína al 0.5% o al 1%.
Nota: Los fármacos parenterales deben revisarse a simple vista con el objeto de detectar la presencia de partículas antes de su administración; CEFEPIMA no debe utilizarse cuando se detectan partículas.
Como ocurre con otras cefalosporinas, el color del polvo y la solución de CEFEPIMA puede oscurecerse al almacenarse, sin embargo, esto no afecta su potencia.
MANIFESTACIONES Y MANEJO DE
Los síntomas de sobredosis incluyen encefalopatía (disturbios de la conciencia incluyendo confusión, alucinación, estupor y coma), mioclonus, convulsiones y excitabilidad neuromuscular.
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Protéjase de la luz. Hecha la mezcla, el producto se conserva
24 horas a temperatura ambiente a no más de
No se congele. Consérvese a temperatura ambiente a no
más de
LEYENDAS DE PROTECCIÓN:
Literatura exclusiva para médicos. Su venta
requiere receta médica.
No se administre si la solución no es transparente, si contiene partículas
en suspensión o sedimentos, o si el cierre ha sido violado.
Si no se administra todo el producto deséchese el sobrante.
No se deje al alcance de los niños.
NOMBRE Y DOMICILIO DEL LABORATORIO:
Véase Presentación o Presentaciones.
PRESENTACIÓN O PRESENTACIONES:

Fuente: S.S.A. Catálogo de Medicamentos Genéricos Intercambiables para farmacias
y público en general al 3 de agosto de 2007.
Con el objeto de demostrar la intercambiabilidad a que se refiere el artículo
75 del reglamento de Insumos para
el Catálogo de Medicamentos Genéricos Intercambiables han sido comparados,
siguiendo los lineamientos indicados por
contra los productos innovadores o de referencia enlistados en las págs.