Carbamazepina
Tabletas, suspensión oral
Antiepiléptico
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada TABLETA contiene:
Carbamazepina............................................................... 200 mg
Cada 100 ml de SUSPENSIÓN contienen:
Carbamazepina......................................................................
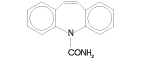
CARBAMAZEPINA es un agente antiepiléptico y analgésico específico para la neuralgia trigeminal. Su nombre químico es 5H-dibenzo-[b,f]-azepina-5-carboxamida, con un peso molecular es 236.27. La estructura química es la siguiente:
INDICACIONES TERAPÉUTICAS:
Epilepsia: CARBAMAZEPINA está indicada como antiepiléptico. La evidencia que apoya la eficacia del medicamento como antiepiléptico se obtuvo de estudios controlados con fármaco activo en los que participaron pacientes con los siguientes tipos de epilepsia:
– Epilepsia parcial con sintomatología compleja (psicomotora y del lóbulo temporal). Los pacientes con este tipo de epilepsia parecen mostrar una mayor mejoría que los pacientes con otros tipos de epilepsia.
– Epilepsia tónico-clónica generalizadas (gran mal).
– Patrones de epilepsia mixta que incluyen las anteriores, u otras epilepsias parciales o generalizadas.
Las ausencias (pequeño mal) parece que no se pueden controlar con CARBAMAZEPINA.
Neuralgia trigeminal: CARBAMAZEPINA está indicada para el tratamiento del dolor asociado con la neuralgia trigeminal verdadera. También se han reportado resultados benéficos en la neuralgia glosofaríngea. Este fármaco no es un analgésico simple, y no se debe usar para aliviar dolores o molestias triviales.
CONTRAINDICACIONES:
CARBAMAZEPINA no se debe usar en pacientes con antecedentes
de depresión de la médula ósea, hipersensibilidad al fármaco, miastenia
gravis, porfiria aguda intermitente, o sensibilidad conocida a cualquiera
de los compuestos tricíclicos como amitriptilina, desipramina, imipramina,
protriptilina, nortriptilina, etc. De igual manera y por razones teóricas
no se recomienda su uso con inhibidores
de la monoaminooxidasa (MAO). Antes de administrar CARBAMAZEPINA
se debe interrumpir la administración de los inhibidores de
PRECAUCIONES GENERALES:
El diazepam o los barbitúricos pueden agravar la depresión respiratoria (en especial en niños), hipotensión y coma. Además, no se deben usar los barbitúricos si el paciente también ha tomado un fármaco que inhibe a la monoaminooxidasa, ya sea como sobredosis o en terapia reciente (dentro de una semana). Durante varios días se debe vigilar la respiración, función cardiaca (monitoreo ECG), presión sanguínea, temperatura corporal, reflejos pupilares, y la función de los riñones y la vejiga.
Si aparece evidencia de depresión significativa de la médula ósea se sugieren las siguientes recomendaciones:
– Interrumpir la administración del fármaco.
– Realizar CBC diario, cuenta de plaquetas y reticulocitos.
– Realizar inmediatamente aspiración de médula ósea y biopsia trefina, y repetir con suficiente frecuencia hasta la recuperación.
Pueden ser útiles estudios periódicos especiales como: anticuerpos en contra de leucocitos y plaquetas; estudios de ferrocinética con 59Fe; tipificación de células sanguíneas periféricas; estudios citogenéticos en médula y sangre periférica; estudios de cultivo de médula para detectar unidades formadoras de colonias; electroforesis de hemoglobina para hemoglobina A2 y F; y niveles séricos de ácido fólico y vitamina B12.
La anemia aplásica totalmente desarrollada requerirá de un adecuado seguimiento intensivo y terapia, con una consulta especializada.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y
Categoría de riesgo C: En estudios de reproducción realizados en ratas se ha demostrado
que CARBAMAZEPINA tiene efectos adversos cuando se administra por vía oral,
en dosis de
En las revisiones retrospectivas sugieren que, en comparación con la monoterapia, puede haber mayor incidencia de efectos teratogénicos asociados con el uso de antiepilépticos en las terapias de combinación. Por tanto, se recomienda la monoterapia para las mujeres embarazadas.
Es importante mencionar que los fármacos antiepilépticos no deben interrumpirse en pacientes en las que el medicamento es administrado para prevenir crisis convulsivas mayores, en virtud de la elevada posibilidad de precipitar un estado epiléptico con hipoxia concomitante y amenaza para la vida. En casos individuales en donde la severidad y frecuencia del trastorno epiléptico es tal que la suspensión del medicamento no posee una amenaza severa para la paciente, se puede considerar interrumpir el fármaco antes y durante el embarazo, aunque no se puede aseverar con absoluta certeza que, aun, las epilepsias menores no representan cierto riesgo para el desarrollo del embrión o feto. No se conoce el efecto de CARBAMAZEPINA en el trabajo de labor y de parto.
CARBAMAZEPINA y su metabolito epóxido pasan a la leche
materna. La relación entre la concentración en leche materna y la concentración
plasmática en mujeres lactando es aproximadamente de 0.4 para CARBAMAZEPINA,
y de 0.5 para el epóxido. Las dosis estimadas que reciben los recién nacidos
durante la lactancia están en el intervalo de
Debido a la posibilidad de reacciones adversas severas causadas por CARBAMAZEPINA en los lactantes se debe decidir si interrumpir la lactancia o el medicamento, considerando la importancia del fármaco para la madre.
REACCIONES SECUNDARIAS Y ADVERSAS:
El médico debe estar consciente de que la interrupción
abrupta de todo fárma-
co antiepiléptico en un paciente epiléptico sensible puede provocar epilepsias
o incluso un estado epiléptico, con riesgos que ponen en peligro la vida.
Las reacciones adversas más severas se han observado en el sistema hematopoyético,
la piel y el sistema cardiovascular.
Las reacciones adversas observadas con más frecuencia, en particular durante las fases iniciales de la terapia son: vértigo, somnolencia, inestabilidad, náusea y vómito. Para minimizar la posibilidad de estas reacciones se debe iniciar la terapia con la dosis más baja recomendada.
Se han reportado las siguientes reacciones adversas:
Sistema hematopoyético: Anemia aplásica, agranulocitosis, pancitopenia, depresión de la médula ósea, trombocitopenia, leucopenia, leucocitosis, eosinofilia y porfiria intermitente aguda.
Piel: Erupción prurítica y eritematosa, urticaria, necrólisis epidémica tóxica (síndrome de Lyell), síndrome de Stevens-Johnson, reacciones de fotosensibilidad, eritema multiforme y nudoso, agravamiento del lupus eritematoso diseminado, alopecia y diaforesis.
Sistema cardiovascular: Insuficiencia cardiaca congestiva, agravamiento de la hipertensión, hipotensión, síncope y colapso, agravamiento de enfermedad arteriocoronaria, arritmias y bloqueo AV, principalmente tromboflebitis, recurrencia de tromboflebitis, tromboembolia y adenopatía o linfadenopatía.
Hígado: Anormalidades en las pruebas de función hepática, hepatitis, ictericia colestática y hepatocelular.
Sistema respiratorio: Hipersensibilidad pulmonar caracterizada por fiebre, disnea, neumonitis o neumonía.
Sistema genitourinario: Frecuencia urinaria, retención urinaria aguda, oliguria con presión sanguínea aumentada, azoemia, insuficiencia renal, e impotencia. También se ha reportado albuminuria, glucosuria y BUN aumentado.
Sistema nervioso: Vértigo, somnolencia, trastornos en la coordinación, confusión, cefalea, fatiga, visión borrosa, alucinaciones visuales, diplopía pasajera, trastornos oculomotores, nistagmo, trastornos en el habla, movimientos involuntarios anormales, neuritis y parestesias periféricas, depresión con agitación, verborrea, tinnitus e hiperacusia.
Sistema digestivo: Náusea, vómito, malestar gástrico y dolor abdominal, diarrea, constipación, anorexia, y sequedad de la boca y faringe, incluyendo glositis y estomatitis.
Ojos: Se han reportado casos de opacidad del cristalino con puntos diseminados, así como conjuntivitis.
Sistema músculo-esquelético: Artralgias, mialgias y calambres en las piernas.
Metabólicas: Fiebre y escalofrío. Se ha reportado el síndrome de secreción inadecuada de la hormona antidiurética (ADH). Asimismo, se han reportado casos de intoxicación franca por agua, con niveles disminuidos de sodio en suero (hiponatremia) y confusión, en asociación con el uso de CARBAMAZEPINA. Se han publicado niveles disminuidos de calcio en plasma.
Otras: Se han reportado casos aislados de síndrome similar a lupus eritematoso sistémico. Pocas veces se han reportado niveles aumentados de colesterol, colesterol de HDL y triglicéridos en pacientes que toman agentes antiepilépticos. Se ha reportado un caso de meningitis aséptica, acompañada de mioclonias y eosinofilia periférica en un paciente que estaba tomando CARBAMAZEPINA en combinación con otros medicamentos.
Los medicamentos fueron suspendidos, y cesó la meningitis, pero volvió a aparecer al administrar de nueva cuenta CARBAMAZEPINA. Ninguna evidencia de abuso potencial se ha asociado con CARBAMAZEPINA ni existe evidencia de dependencia psicológica o física en humanos.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
Han ocurrido interacciones medicamentosas importantes con medicamentos concomitantes, que incluyen pero no se limitan a los siguientes:
Agentes que pueden afectar los niveles plasmáticos de CARBAMAZEPINA: Los inhibidores del CYP 3A4 inhiben el metabolismo de CARBAMAZEPINA y, por tanto, pueden aumentar sus niveles plasmáticos. Los fármacos que se ha demostrado o es de esperarse que aumenten los niveles plasmáticos de CARBAMAZEPINA incluyen: cimetidina, danazol, diltiazem, macrólidos, eritromicina, troleandomicina, claritromicina, fluoxetina, loratadina, terfenadina, isoniacida, niacinamida, nicotinamida, propoxifeno, ketoconazol, itraconazol y valproato de verapamilo.
Los inductores del CYP 3A4 pueden aumentar la velocidad del metabolismo de CARBAMAZEPINA. Los fármacos que se ha demostrado o que se espera que disminuyan los niveles plasmáticos de CARBAMAZEPINA incluyen: cisplatino, clorhidrato de doxorrubicina, felbamato, rifampina, fenobarbital, fenitoína, primidona y teofilina.
CARBAMAZEPINA aumenta los niveles de clorhidrato de clomipramina, fenitoína y primidona. Este medicamento induce la actividad del CYP hepático. Por tanto, es de esperar que CARBAMAZEPINA disminuya los niveles de los siguientes fármacos: paracetamol, alprazolam, clonazepam, clozapina, dicumarol, doxiciclina, etosuximida, haloperidol, metosuximida, anticonceptivos orales, fensuximida, fenitoína, teofilina, valproato y warfarina.
La administración concomitante de CARBAMAZEPINA y litio puede aumentar el riesgo de efectos secundarios neurotóxicos.
Se han reportado alteraciones de la función tiroidea en la terapia de combinación con otros medicamentos antiepilépticos.
Se han reportado hemorragias en los pacientes que reciben de manera concomitante anticonceptivos orales, además, CARBAMAZEPINA puede reducir la efectividad de ellos.
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS,
MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE
CARBAMAZEPINA puede causar anemia aplásica y agranulocitosis. Los pacientes con antecedentes de reacción hematológica adversa a cualquier fármaco pueden estar particularmente en riesgo. Se han reportado reacciones dermatológicas severas con CARBAMAZEPINA, incluyendo necrólisis epidérmica tóxica (síndrome de Lyell) y síndrome de Stevens-Johnson.
Estas reacciones han sido extremadamente raras; sin embargo, se han reportado algunas muertes. CARBAMAZEPINA ha mostrado actividad anticolinérgica moderada; por tanto, los pacientes con presión intraocular aumentada deben vigilarse de manera cuidadosa durante la terapia. Debido a la relación del fármaco con otros compuestos tricíclicos se debe tener en mente la posibilidad de activación de una psicosis latente y de confusión, o agitación en los pacientes ancianos. CARBAMAZEPINA se debe usar con precaución en pacientes con trastornos de epilepsia mixta en la que se incluyen ausencias atípicas, ya que en estos pacientes CARBAMAZEPINA se ha asociado con un aumento en la frecuencia de convulsiones.
Cuando se administró CARBAMAZEPINA en la dieta de ratas Sprague-Dawley durante dos años, a dosis de 25, 75 y 250 mg/kg/día, resultó en un aumento, relacionado con la dosis, de la incidencia de tumores hepatocelulares en las hembras, y adenomas benignos de las células intersticiales en los testículos de los machos.
Por tanto, CARBAMAZEPINA se debe considerar como carcinogénica en las ratas Sprague-Dawley. Los estudios de mutagenicidad en bacterias y mamíferos usando CARBAMAZEPINA produjeron resultados negativos. Actualmente no se conoce la significancia de estos hallazgos en relación al uso de CARBAMAZEPINA en humanos. Los experimentos en animales han demostrado que CARBAMAZEPINA aumenta la mortalidad embrionaria y causa retraso en el crecimiento cuando se administra a dosis entre 10 y 25 veces superiores a la usada en los seres humanos. Asimismo, la administración de 300 mg/kg a las ratas, causó un aumento en la incidencia de abortos. Los ratones que recibieron dosis entre 40 y 240 mg/kg mostraron dilatación de los ventrículos cerebrales en 4.7% de los casos, en comparación con 1% de los controles.
DOSIS Y VÍA DE ADMINISTRACIÓN:
Suspensión:
Debe agitarse antes de tomarse y puede ser administrada durante, después o entre las comidas, con el siguiente esquema:
Una cucharada es igual a 5 ml, lo que equivale a 100 mg.
Para niños menores de 4 años, la dosis inicial es de
En mayores de cuatro años, la dosis inicial debe ser de 100 mg/día, con incrementos semanales de 100 mg.
La dosis de mantenimiento en ambos casos es de
Niños menores de 1 año:
Niños de
Niños de
Niños de
Adultos: Dosis de
En la neuralgia del trigémino: Inicialmente, dosis de
El seguimiento de los niveles sanguíneos ha aumentado la eficacia y seguridad de los agentes antiepilépticos. Se deben ajustar las dosis de acuerdo con las necesidades del paciente individual. Se aconseja administrar una dosis baja inicial diariamente con un aumento gradual. Tan pronto como se logre el control adecuado, se puede disminuir la dosis de manera gradual hasta el nivel mínimo efectivo. El medicamento debe tomarse con los alimentos.
Cambio de CARBAMAZEPINA oral en tabletas por CARBAMAZEPINA en suspensión: En los pacientes, se debe cambiar la forma farmacéutica administrando el mismo número de mg/día, en dosis menores y más frecuentes (por ejemplo, cambio de tabletas dos veces al día a suspensión tres veces al día).
Epilepsia:
Adultos y niños mayores de 12 años:
Tratamiento inicial:
Administrar 200 mg, dos veces al día en tabletas. Aumentar en intervalos semanales
agregando hasta 200 mg/día, usando un régimen de dosificación de dos veces
al día para las tabletas de liberación prolongada de CARBAMAZEPINA, o un régimen
de 3 veces o 4 veces al día para otras formulaciones hasta que se obtenga
la respuesta óptima. En general, la dosis no debe exceder de 1,000 mg/día
en niños de
Mantenimiento: Ajustar la dosis al nivel mínimo efectivo, usualmente entre 800 y 1,200 mg/día.
Niños de
Tratamiento inicial: Administrar tabletas de 100 mg dos veces al día. Aumentar en intervalos regulares, agregando hasta 100 mg/día, usando un régimen de dosificación de dos veces al día para las tabletas de liberación prolongada de CARBAMAZEPINA, o un régimen de 3 ó 4 veces al día para las otras formulaciones, hasta que se obtenga la respuesta óptima. En general, la dosis no debe exceder de 1,000 mg/día.
Mantenimiento: Ajustar la dosis en el nivel mínimo efectivo, usualmente
Niños menores de 6 años:
Tratamiento inicial:
Mantenimiento: Normalmente, la respuesta clínica óptima se alcanza con dosis diarias
menores de 35 mg/kg. Si no se ha logrado una respuesta clínica satisfactoria,
se deben medir los niveles en plasma para determinar si se encuentran en el
intervalo terapéutico. No se pueden realizar recomendaciones referentes a
la seguridad de CARBAMAZEPINA para uso con dosis por arriba de 35 mg/kg/
24 horas.
Terapia de combinación: CARBAMAZEPINA se puede usar sola o con otros agentes antiepilépticos. Cuando se agrega a una terapia anticonvulsiva existente, el fármaco se debe agregar poco a poco, mientras los otros agentes antiepilépticos se mantienen o disminuyen gradualmente; excepto la fenitoína, la cual debe aumentarse.
Neuralgia trigeminal:
Tratamiento inicial: En el primer día, 100 mg dos veces al día. Esta dosis diaria se puede elevar hasta 200 mg/día con aumentos de 100 mg cada 12 horas hasta lograr el alivio del dolor. No exceder de 1,200 mg/día.
Mantenimiento: El control del dolor se puede obtener en la mayoría de los pacientes
con
MANIFESTACIONES
Y MANEJO DE
Toxicidad aguda:
Dosis mínima letal conocida: en adultos, más de 60 g (hombre de 39 años). Dosis máximas conocidas con supervivencia:
adultos,
3 años).
Signos y síntomas:
Los primeros signos y síntomas aparecen después de
Respiración: Respiración irregular, depresión respiratoria.
Sistema cardiovascular: Taquicardia, hipotensión o hipertensión, choque, trastornos en la conducción.
Sistema nervioso y músculos: Trastornos de la conciencia, de severidad variable hasta coma profundo; convulsiones, especialmente en niños pequeños, inquietud motora, sacudidas musculares espasmódicas, tremor, movimientos atetoides, opistótonos, ataxia, somnolencia, vértigo, midriasis, nistagmo, adiadococinesia, balismo, trastornos psicomotores, y dismetría; hiperreflexia inicial, seguida por hiporreflexia.
Tracto gastrointestinal: Náusea y vómito.
Riñones y vejiga: Anuria u oliguria y retención urinaria.
Hallazgos de laboratorio: Casos aislados de sobredosis han incluido leucocitosis, cuenta baja de leucocitos, glucosuria y acetonuria. El ECG puede mostrar disritmias.
Envenenamiento combinado: Los signos y síntomas de envenenamiento con CARBAMAZEPINA se pueden agravar o modificar cuando al mismo tiempo se ingiere alcohol, antidepresivos tricíclicos, barbitúricos o hidantoínas.
Tratamiento: En casos severos de envenenamiento, el pronóstico depende principalmente de la pronta eliminación del fármaco, por lo que se debe inducir el vómito, irrigando el estómago y realizando las acciones adecuadas para disminuir la absorción. Si no es posible implementar estas medidas sin riesgo en el lugar, transferir al paciente inmediatamente a un hospital, mientras se asegura el mantenimiento de las funciones vitales. No existe un antídoto específico.
Eliminación del fármaco: Inducción del vómito; lavado gástrico. Aun cuando hayan transcurrido más de 4 horas después de la ingestión del fármaco, se debe irrigar el estómago repetidamente, en especial si el paciente también ha consumido alcohol.
Medidas para disminuir la absorción: Carbón activado y laxantes.
Medidas para acelerar la eliminación: Diuresis forzada. La diálisis solamente está indicada en el envenenamiento severo asociado con insuficiencia renal. La transfusión de reemplazo está indicada en el envenenamiento severo en niños pequeños.
Depresión respiratoria: Mantener libres las vías respiratorias, si es necesario, para intubación endotraqueal, respiración artificial y administración de oxígeno.
Hipotensión y choque: Mantener las piernas del paciente en posición elevada, y administrar un expansor de plasma. Si la presión sanguínea decae a pesar de las medidas tomadas para aumentar el volumen de plasma, se debe considerar el uso de sustancias vasoactivas.
Convulsiones: Diacepam o barbitúricos.
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Consérvese a temperatura ambiente a no más de
LEYENDAS DE PROTECCIÓN:
Literatura exclusiva para médicos. No se
deje al alcance de los niños.
Su venta requiere receta médica. El empleo de este medicamento
durante el embarazo queda bajo responsabilidad del médico.
NOMBRE Y DOMICILIO DEL LABORATORIO:
Véase Presentación o Presentaciones.
PRESENTACIÓN O PRESENTACIONES:
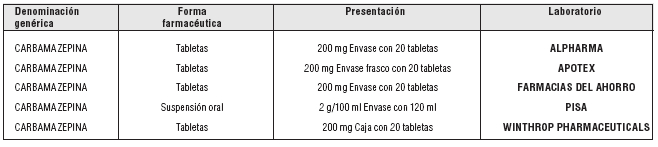
Fuente: S.S.A. Catálogo de Medicamentos Genéricos Intercambiables para farmacias
y público en general al 3 de agosto de 2007.
Con el objeto de demostrar la intercambiabilidad a que se refiere el artículo
75 del reglamento de Insumos para
el Catálogo de Medicamentos Genéricos Intercambiables han sido comparados,
siguiendo los lineamientos indicados por
contra los productos innovadores o de referencia enlistados en las págs.