Captopril
Tabletas
Antihipertensivo inhibidor de
FORMA FARMACÉUTICA Y FORMULACIÓN:
Cada TABLETA contiene:
Captopril.............................................................. 25 mg y 50 mg
INDICACIONES TERAPÉUTICAS:
Hipertensión arterial.
Insuficiencia cardiaca congestiva.
Infarto de miocardio (en el postinfarto después de 72 horas de estabilidad hemodinámica que hayan presentado insuficiencia cardiaca o con evidencia de fracción de eyección disminuida).
Nefropatía diabética (insulinodependientes tanto en normotensos como hipertensos).
CONTRAINDICACIONES:
Está contraindicado en pacientes con hipersensibilidad al CAPTOPRIL o a cualquier otro inhibidor de la enzima convertidora de la angiotensina.
PRECAUCIONES GENERALES:
Angioedema: Se ha reportado angioedema en las extremidades, cara, labios, membranas mucosas, lengua, glositis o laringe en pacientes tratados con IECA, incluyendo al CAPTOPRIL. Si el angioedema involucra a la lengua, la glositis y la laringe, puede ocurrir obstrucción de las vías aéreas y ésta puede resultar fatal. Se debe instituir rápidamente tratamiento de urgencia incluyendo, aunque no necesariamente, la administración subcutánea de adrenalina 1:1000.
El edema de la cara, labios y de las extremidades desaparece con la suspensión del CAPTOPRIL.
Reacciones anafilactoides: Las observaciones clínicas han demostrado la asociación entre las reacciones de hipersensibilidad durante hemodiálisis, con membranas de alto flujo en pacientes que recibían CAPTOPRIL. Por tanto, se debe prestar especial atención en estos pacientes, y sobre todo en aquellos que hayan tenido reacciones similares.
Enfermedades vasculares del colágeno (esclerodermia, lupus eritematoso sistémico): Aumenta el riesgo de aparición de neutropenia o agranulocitosis, especialmente en pacientes con insuficiencia renal grave. Monitorizar.
Hiperpotasemia: Los ECA pueden producir hiperpotasemia por lo que se evitará el tratamiento conjunto con suplementos de potasio o diuréticos ahorradores de potasio.
La evaluación del paciente hipertenso o con insuficiencia cardiaca siempre debe incluir la valoración de la función renal: Si CAPTOPRIL se utiliza en pacientes con alteración de la función renal, se debe evaluar la cuenta de leucocitos y la cuenta diferencial antes de empezar el tratamiento y a intervalos de aproximadamente dos semanas durante tres meses, posteriormente en forma periódica. En pacientes con enfermedades del colágeno o que están expuestos a otros fármacos que se sabe afectan las células blancas de la respuesta inmune, en particular cuando se encuentra afectada la función renal, CAPTOPRIL sólo se debe usar después de una evaluación del riesgo/beneficio y con precaución.
Proteinuria: En los pacientes que recibieron CAPTOPRIL
se encontró proteinuria mayor de
En la quinta parte de los pacientes con proteinuria se observó síndrome nefrótico. En la mayoría de los casos, la proteinuria desapareció en un periodo de 6 meses con o sin CAPTOPRIL.
En los pacientes con proteinuria, los parámetros de función renal como el nitrógeno ureico y la creatinina, rara vez se alteraron.
Hipotensión: Rara vez se ha observado hipotensión excesiva en pacientes hipertensos, pero es una posible consecuencia del uso del CAPTOPRIL en individuos depletados de sal/volumen, en pacientes con insuficiencia cardiaca o en diálisis renal. En la insuficiencia cardiaca, o cuando la presión arterial era normal o baja; aproximadamente la mitad de los pacientes presentó disminución transitoria mayor de 20% de la presión sanguínea media.
Esta hipotensión transitoria es más frecuente que ocurra después de alguna de las primeras dosis y, por lo general, es bien tolerada y no produce síntomas, o únicamente mareo leve, aunque en raras ocasiones se ha asociado con arritmias o trastornos de la conducción.
Debido a la potencial caída de la presión arterial en estos pacientes, el tratamiento se debe iniciar bajo estrecha vigilancia médica.
La hipotensión por sí misma no es una razón para la suspensión del tratamiento. Este efecto se estabiliza en una o dos semanas, y por lo general regresa a los niveles previos al tratamiento en cerca de dos meses sin reducción de la eficacia terapéutica.
Hipertensión: Algunos pacientes con alteración renal, en particular aquéllos con estenosis arterial severa, han desarrollado elevaciones de urea y creatinina sérica después de la reducción de la presión sanguínea con CAPTOPRIL.
Insuficiencia cardiaca: Aproximadamente 20% de los pacientes desarrollan elevaciones estables de urea y creatinina sérica mayores de 20% por arriba de lo normal o de la basal, durante el tratamiento a largo plazo con CAPTOPRIL.
Hipercaliemia: En algunos pacientes tratados con CAPTOPRIL se han observado elevaciones de potasio sérico. Cuando se utilizan IECA, los pacientes en riesgo de desarrollar hipercaliemia son aquéllos con insuficiencia renal; diabetes mellitus y los que recibieron de manera conjunta diuréticos ahorradores de potasio.
Tos: Con el uso de IECA se ha reportado tos. En forma característica, la tos no es productiva, es persistente y desaparece después de suspender el tratamiento.
Estenosis valvular: Con bases teóricas, se piensa que los pacientes con estenosis aórtica pueden estar en riesgo de disminución de la perfusión coronaria cuando son tratados con vasodilatadores, debido a que desarrollan disminución de la poscarga.
Cirugía/anestesia: En pacientes en quienes se realiza una cirugía mayor o durante la anestesia con agentes que producen hipotensión, CAPTOPRIL bloquea la formación de angiotensina II, secundaria a la liberación compensadora de renina.
Si el paciente presenta hipotensión, y se considera que es debido a este mecanismo, se puede corregir mediante expansión de volumen.
RESTRICCIONES DE USO DURANTE EL EMBARAZO Y
Categoría de riesgo C (primer trimestre) y D (segundo y tercer trimestres): Morbilidad y mortalidad fetal y neonatal.
Cuando se utiliza durante el segundo y tercer trimestres puede ocasionar daño e incluso la muerte del feto en desarrollo. Cuando se detecte el embarazo se debe descontinuar.
El uso durante el segundo y tercer trimestres del embarazo se ha asociado con daño fetal y neonatal, incluyendo hipotensión, hipoplasia craneal neonatal, anuria, insuficiencia renal reversible e irreversible y muerte. También se ha reportado, oligohidramnios, deformidad craneofacial, hipoplasia pulmonar, premadurez, retardo del crecimiento intrauterino y persistencia del conducto arterioso.
Lactancia: Las concentraciones de CAPTOPRIL en la leche humana son aproximadamente de 1% de la existente en la sangre materna.
Debido a que existe la posibilidad de reacciones adversas serias en el lactante se debe tomar la decisión de suspender la lactancia o el fármaco, considerando la importancia de CAPTOPRIL para la madre.
REACCIONES SECUNDARIAS Y ADVERSAS:
Renales: Aproximadamente
1 de cada 100 pacientes desarrolla proteinuria y
1 a 2 de cada 1,000 han presentado insuficiencia renal, insuficiencia renal
aguda, síndrome nefrótico, poliuria, oliguria y frecuencia urinaria.
Hematológicas: Se ha presentado leucopenia/agranulocitosis, anemia, trombocitopenia, pancitopenia.
Dermatológicas: A menudo se presenta erupción con prurito; algunas veces fiebre, artralgias y eosinofilia; por lo regular, la erupción es leve y desaparece con la disminución de la dosis, con antihistamínicos o suspendiendo el medicamento. También se han reportado lesiones reversibles que semejan penfigoide y fotosensibilidad. Puede haber enrojecimiento o palidez.
Cardiovasculares: Se ha reportado hipotensión, taquicardia, dolor torácico, palpitaciones, angina de pecho, infarto agudo al miocardio, insuficiencia cardiaca y síndrome de Raynaud.
Pérdida de la percepción del gusto: Es reversible y por lo general se autolimita, aun cuando se continúe con la administración del fármaco.
Angioedema: Se ha reportado angioedema en cara, labios, mucosas orales y en las extremidades.
Otras: Pénfigo buloso; eritema multiforme (incluyendo síndrome de Stevens-Johnson) dermatitis exfoliativa, pancreatitis, glositis y dispepsia; anemia, incluyendo aplásica y hemolítica; ictericia, hepatitis, necrosis, colestasis, broncospasmo, neumonitis eosinofílica, rinitis, visión borrosa, impotencia, hiponatremia sintomática, mialgia, miastenia, ataxia, confusión, depresión, nerviosismo y somnolencia.
INTERACCIONES MEDICAMENTOSAS Y DE OTRO GÉNERO:
El efecto hipotensor se ve aumentado con medicamentos del tipo de diuréticos, inhibidores de calcio, beta-bloqueadores adrenérgicos, vasodilatadores, liberadores de renina, bloqueadores ganglionares barbitúricos, alcohol, narcóticos, fenfluramina y diazóxido.
Se observa disminución del efecto hipotensor con AINEs, colestiramina. Los medicamentos ahorradores de potasio sólo se deben administrar con precaución, debido a que pueden presentar un aumento de potasio sérico.
Con la administración concomitante de corticosteroides, ACTH y ketanserina, puede ocasionarse hipocaliemia y deficiencias de otros electrólitos. Con el tratamiento concomitante de CAPTOPRIL y/o tiazidas se ha observado elevación de la concentración de litio sérico. La indometacina puede disminuir el efecto antihipertensivo del CAPTOPRIL sobre todo en pacientes con renina baja.
Litio: Se ha reportado aumento del litio sérico y síntomas de toxicidad
en pacientes que reciben tratamiento concomitante con inhibidores de
PRECAUCIONES EN RELACIÓN CON EFECTOS DE CARCINOGÉNESIS,
MUTAGÉNESIS, TERATOGÉNESIS Y SOBRE
No se han reportado hasta la fecha.
DOSIS Y VÍA DE ADMINISTRACIÓN:
La dosis debe ser individual.
En la hipertensión
arterial: La dosis inicial es de 50 mg una vez
al día, o
25 mg dos veces al día.
Si no se obtiene una disminución satisfactoria de la presión arterial después de una o dos semanas, se puede aumentar la dosis a 100 mg una vez al día en una sola toma o dividida en dos tomas.
En general, la dosis habitual no debe exceder de 150 mg/día. La dosis máxima diaria no debe sobrepasar de 450 mg/día.
En insuficiencia cardiaca: La dosis diaria habitual es de 25 mg dos o tres veces al día y se puede elevar hasta 50 mg/día, dos o tres veces al día, los aumentos se deben diferir una o dos semanas, para valorar si ha existido una respuesta adecuada.
En infarto al miocardio: El tratamiento se debe iniciar después del infarto, luego de administrar una dosis inicial de 6.25 mg el tratamiento con CAPTOPRIL se debe aumentar a 37.5 mg diarios, divididos en varias dosis de acuerdo con la tolerancia; después a 75 mg diarios y finalmente a una dosis de 150 mg diarios, en dosis divididas durante las semanas subsiguientes.
Nefropatía diabética:
La dosis diaria es de
No se ha establecido en los niños la seguridad y eficacia. Existe poca experiencia en la literatura; los niños, en especial los recién nacidos, pueden ser más susceptibles a los efectos hemodinámicos adversos del CAPTOPRIL.
MANIFESTACIONES
Y MANEJO DE
La corrección de la hipotensión debe ser de capital importancia. La expansión de volumen con una solución intravenosa salina isotónica es el tratamiento de elección para restaurar la presión arterial.
Aun cuando CAPTOPRIL puede extraerse de la circulación en el adulto, mediante hemodiálisis, no se tiene suficiente experiencia respecto a la efectividad de la hemodiálisis para extraerlo en niños y en recién nacidos. La diálisis peritoneal no es efectiva para extraer CAPTOPRIL; no hay suficiente información respecto a la exanguinotransfusión para extraer CAPTOPRIL de la circulación general.
RECOMENDACIONES SOBRE ALMACENAMIENTO:
Consérvese a temperatura ambiente a no más de
Proteger de la humedad. Mantener los frascos bien tapados.
LEYENDAS DE PROTECCIÓN:
Literatura exclusiva para médicos.
No se deje al alcance de los niños.
Su venta requiere receta médica.
NOMBRE Y DOMICILIO DEL LABORATORIO:
Véase Presentación o Presentaciones.
PRESENTACIÓN O PRESENTACIONES:
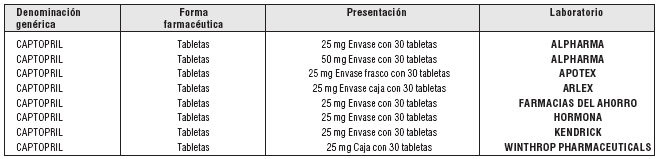
Fuente: S.S.A. Catálogo de Medicamentos Genéricos Intercambiables para farmacias
y público en general al 3 de agosto de 2007.
Con el objeto de demostrar la intercambiabilidad a que se refiere el artículo
75 del reglamento de Insumos para
el Catálogo de Medicamentos Genéricos Intercambiables han sido comparados,
siguiendo los lineamientos indicados por
contra los productos innovadores o de referencia enlistados en las págs.