Los generadores centrales de patrones (GCPs) son redes neuronales que sin entradas sensoriales periféricas o centrales (esto es, en forma endógena), producen salidas con patrones rítmicos. Fueron descubiertos en animales invertebrados (acocil y langosta) hace ya mas de 50 años por Wiersma y Hughes (1960) en la cadena deaferentada del acocil y por Wilson (1961) en la de la langosta, siendo descritos por Bullock (1961). Ellos encontraron que en ocasiones, la cadena nerviosa deaferentada del acocil seguía produciendo descargas de espigas en forma coordinada en los axones motores que inervan diferentes patas para nadar, lo que significaba que el patrón motor que coordina los movimientos de los cuatro pares de patas (Figura 1B) no podía depender ciclo por ciclo de retroalimentación propioceptiva de las extremidades, ya que habían cortado todas las conexiones a esas extremidades. Sus funciones en invertebrados son claras y, por ejemplo, en el acocil manejan el movimiento de los cuatro pares de extremidades abdominales que ayudan al animal a nadar hacia adelante, lo que hacen sin necesidad de mandar señales aferentes al sistema nervioso central. En la misma forma, en la langosta controlan los músculos que manejan las alas, que son movidos sin necesidad de retroalimentación propioceptiva.
Una demostración de que los GCPs son generadores rítmicos endógenos es el registro de los llamados "patrones motores ficticios". Por ejemplo, cuando el patrón de actividad de una motoneurona aislada es igual al que genera cuando inerva su músculo, ese registro se denomina patrón motor ficticio y es una demostración de que su generación es endógeno y no requiere entradas sensoriales. Demostraciones claras de este patrón se han obtenido sólo en unas pocas preparaciones de invertebrados, en los que los GCPs y los músculos que inervan han podido ser mantenidos in vitro simultáneamente y también se ha registrado su patrón de salida para mostrar una salida motora específica.
En preparaciones con nervios que tienen un gran número de axones es mas difícil demostrar que las mismas motoneuronas están activas in vivo e in vitro. En estos casos, la demostración de que la actividad nerviosa correcta continúa in vitro (esto es, que la actividad de motoneuronas extensoras y flexoras mantiene las relaciones de fase correctas), sin demostrar que motoneuronas idénticas están disparando, frecuentemente se considera evidencia suficiente de un patrón motor ficticio. Lo importante es que la generación de patrones rítmicos no depende del sistema nervioso funcionando en forma completa, sino de los GCPs, que son redes nerviosas relativamente pequeñas y autónomas.
La sorpresa del hallazgo de GCPs se debió a que cuando fueron descubiertos, en 1960 y 1961, la idea dominante era que los patrones motores de gran complejidad requerían información propioceptiva de la periferia, lo que se basaba en la observación de que cuando la médula espinal de mamíferos era seccionada, había una parálisis flácida irreversible.

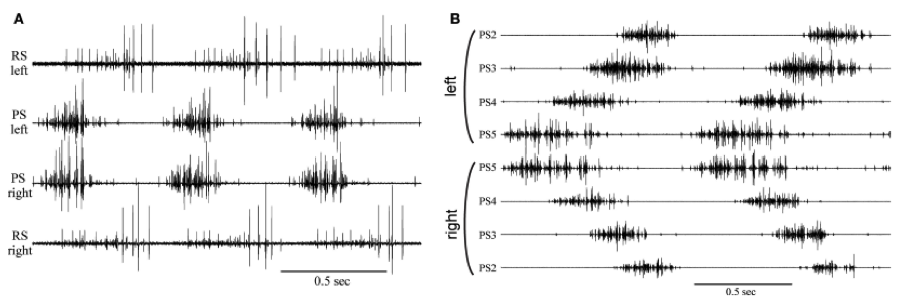
Figura 1. Salidas motoras coordinadas en los nervios de las patas para nadar en la cadena nerviosa abdominal del acocil. A. Tres ciclos de salidas motoras del par de patas en los lados izquierdo y derecho de un segmento abdominal. B. Ocho registros simutáneos mostrando dos ciclos de disparo en axones que inervan cuatro pares de patas en cuatro segmentos del abdomen. (Mulloney y Smarandache, 2010)
Esos resultados llevaron a la sugestión de que cada extremidad tenía un "centro de coordinación" y que estos centros estaban interconectados para producir el patrón característico de progresión de la actividad de atrás hacia adelante. Sin embargo, la primera indicación de cómo funcionan las neuronas que inervan los músculos de las extremidades de los invertebrados, fue el hallazgo de que están organizadas por medio de sinápsis inhibitorias recíprocas. Los somas de estas neuronas se localizan en el mismo lado de las extremidades que inervan y están separados de las neuronas que inervan la extremidad del lado contralateral. Además, las interneuronas que coordinan las neuronas en cada grupo tienen estructuras unilaterales y sus ramas están restringidas a la cercanía de la base del nervio de la extremidad a través del cual llegan los axones motores a sus blancos.
Si la conducción de la información que coordina las neuropilas laterales es bloqueada, los circuitos en lados opuestos a cada ganglio de la extremidad pueden continuar produciendo oscilaciones alternas de potenciales de membrana en neuronas funcionalmente antagonistas y estas oscilaciones no están coordinadas con la actividad en la neuropila opuesta. Así, las dos neuropilas laterales del ganglio de cada extremidad son la base anatómica de los "centros de coordinación", donde, por medio de los circuitos generadores de patrones, se organizan las descargas alternas de espigas de las motoneuronas que producen el movimiento de fuerza y el de retorno.
Después de esos resultados hubo una tendencia inicial a pensar que los GCPs estaban limitados a la locomoción de artrópodos en agua y aire, pero experimentos en los que se deaferentaron otros animales demostró que los GCPs también funcionan durante el nado, la marcha y la respiración. Poco después se demostró la locomoción ficticia en la médula espinal seccionada y aislada de gatos, y todos estos conocimientos han sido aplicados a la clínica para el tratamiento de personas con lesiones de la médula espinal.
La importancia de los GCPs para nosotros ahora es que varias de las conductas rítmicas en los humanos, como la marcha, el movimiento alterno del tórax que produce la respiración y la masticación, parecen estar manejadas por GCPs semejantes a los descritos en animales invertebrados. Estos circuitos se encuentran en la profundidad de la médula espinal y aunque no han sido completamente caracterizados, su comportamiento es tan parecido al que se ve en animales invertebrados, que aún en ausencia de su completa demostración aceptamos que esas conductas son manifestaciones externas de la alternancia en la oscilación de sus señales.
Las investigaciones sobre los GCPs consisten en identificar los procesos e interacciones que subyacen los ritmos generados por las neuronas. La ritmicidad neural se inicia a través de interacciones entre las neuronas (ritmicidad basada en redes) o a través de interaciones entre corrientes iónicas en neuronas individuales (neuronas osciladoras endógenas). Un ejemplo claro de ritmicidad basada en redes es proporcionado por el GCPs del latido cardíaco de la sanguijuela. Esta red es poco frecuente porque puede ser dividida en subgrupos, uno de los cuales (el ritmo generador) produce el ritmo básico del patrón y el otro (el patrón generador) responde a las entradas del ritmo generador, generando el patrón motor actual. Es posible que este sea el ejemplo mas cercano a los GCPs que se cree se encuentran en los humanos para generar la marcha.
Figura 2. Mecanismos de la ritmicidad del generador central de patrones. a) Ritmicidad basada en redes (generador del ritmo del latido del corazón de la sanguijuela). La red (arriba, izquierda) consiste en un anillo de seis neuronas interconectadas con sinápsis inhibitorias recíprocas. Los pares de neuronas 3 y 4 son particularmente importantes ya que cada uno de los cuales forma un oscilador medio-central (ver el texto). Las neuronas de cada par descargan en antifase (arriba, derecha), mientras las neuronas 1 y 2 forman una unión coordinada entre los medio-centros de la neurona 3 y la neurona 4; la red produce un patrón de dos fases en el cual las neuronas que abren y cierran descargan en antifase (izquierda). Las flechas indican la depolarización lenta que permite a la neurona-off escapar de la inhibición (ver el texto). Modificado de Marder y Calabrese (1996). b) La red pilórica de la langosta es manejada por una neurona osciladora endógena. Izquierda, el complemento de la red neuronal y la interconectividad sináptica (sinápsis inhibitorias, conectores palo-bola; acoplamiento eléctrico, resistencias; acoplamiento eléctrico rectificante, diodo). La neurona AB es osciladora endógena y en la mayor parte de los casos es la manejadora rítmica de la red. La entrada de la neurona AB induce rebote postinhibitorio y meseta en sus neuronas seguidoras y como consecuencia de estos efectos y las interacciones entre las neuronas seguidoras, la red produce una salida nerviosa rítmica multifase (derecha). Neuronas, VD, dilatora ventricular; PL, pilórica tardía; PE, pilórica temprana.
La Figura 2a izquierda muestra la conectividad sináptica generadora del ritmo. La red consiste de cuatro pares de neuronas bilateralmente simétricas, donde las neuronas 3 y 4 derecha e izquierda se inhiben una a la otra y en cada lado las neuronas 1 y 2 son recíprocamente inhibitorias con las neuronas 3 y 4; entonces, la red forma un anillo de pares de neuronas inhibitorias recíprocas. La Figura 2a derecha muestra registros intracelulares simultáneos de las neuronas 4 derecha e izquierda, donde es aparente que disparan rítmicamente fuera de fase (antifase). Los registros de las otras neuronas de la red muestran que las neuronas 3 y 4 de un lado disparan descargas de potenciales de acción sincrónicos con las neuronas 1 y 2 en el otro lado. Así, la red produce un ritmo de dos fases en el que las neuronas de apertura y cierre (izquierda) descargan en antifase.
La clave para entender la generación del ritmo en esta y muchas otras redes basadas en GCPs, es el concepto de oscilador medio-centro, que consiste en dos neuronas que individualmente no tienen capacidad ritmógena, pero que cuando están acopladas recíprocamente producen salidas rítmicas. Varios tipos de procesos interactivos apoyan la generación de ese ritmo, pero primero describiremos el mecanismo específico de la red que controla el latido del corazón de la sanguijuela.
Considerando solamente el par de neuronas inhibitorias 4, imaginemos que el disparo de una de ellas no sólo inhibe a la otra, sino que también la induce a escapar lentamente de la inhibición. En este caso la ritmogénesis puede iniciarse como sigue. Primero una neurona, digamos la derecha, está activada inhibiendo la neurona izquierda, pero también induciendo en ella una depolarización lenta que eventualmente la lleva al umbral, por lo que empieza a disparar. El disparo en la neurona izquierda inhibe y detiene el disparo de la neurona derecha, pero también induce en ella una depolarización lenta, por lo que la neurona derecha eventualmente llega al umbral y empieza a disparar. Esta actividad inhibe y detiene el disparo de la neurona izquierda y el ciclo se repite.
En el ritmo generador del corazón de la sanguijuela este proceso se entiende ahora a nivel de corrientes iónicas. Una clave es la corriente de entrada activada por la hiperpolarización (Ih) y una persistente corriente de sodio de bajo umbral (Ip) en la neurona 4. En la neurona que está siendo inhibida (la neurona-off), esta hiperpolarización gradualmente inicia Ih y en consecuencia, la neurona-off se depolariza lentamente (nótese la depolarización lenta de las neuronas durante su inhibición; flechas). Cuando el umbral de Ip es cruzado, la neurona-off escapa de la inhibición y empieza a disparar, inhibiendo la neurona que había disparado primero. Ahora Ih empieza a aparecer en esta nueva neurona-off y eventualmente cruza el umbral de I, la nueva neurona off escapa de la inhibición y el proceso se repite.
La ritmogénesis en el ritmo generador del corazón de la sanguijuela ocurre como sigue. Ambas neuronas de los pares de neurona 3 y 4 tienen Ih e Ip y cada par neuronal forma un medio-centro funcional en el que las dos neuronas descargan en antifase. Las neuronas 1 y 2 inhiben las neuronas ipsilaterales 3 y 4 en forma recíproca, por lo que el único modo estable de descarga para las neuronas de un lado es que las neuronas 3 y 4 descarguen juntas y en antifase con las neuronas 1 y 2; el resultado de esto es que la red entera tiene la actividad mostrada en la Figura 1a, derecha. Las neuronas medio-centro 3 y 4 forman el corazón rítmico de la red y las neuronas 1 y 2 coordinan la actividad de estos medio centros (Marder y Calabrese, 1996).
La inhibición recíproca es muy común en las redes GCPs y los osciladores medio-centro han sido modelados en forma extensa. Este trabajo ha revelado que los medio-centros pueden funcionar en varias formas. Primero, las dos neuronas del medio-centro no necesitan disparar en antifase, ya que dependiendo de la dinámica de la liberación sináptica, es posible alcanzar cualquier fase relativa, aún el disparo síncrono de la neurona (Van Vreeswijk et al., 1994). Segundo, además del mecanismo de "escape" mencionado arriba, los medio-centros también pueden funcionar en un modo de 'liberación', en el que como consecuencia de sus propiedades intrínsecas la neurona-on deja de disparar por ella misma. De este modo la neurona-off se activa, no para escapar de la inhibición, sino simplemente por ser liberada de ella. Estos modos pueden ser subdivididos mas dependiendo de si las transiciones ocurren porque el estado de disparo de la neurona cambia (escape intrínseco o liberación) o porque (antes que el disparo de la neurona cambie) las neuronas cruzan el umbral de voltaje que gobierna la liberación de la trasmisión sináptica (escape sináptico o liberación). En cada modo el medio-centro funciona en forma diferente y puede ser desplazado entre los modos por cambios en el úmbral de liberación sináptica (Skinner et al., 1994). Así, las variaciones en las propiedades sinápticas pueden alterar dramáticamente la actividad de los medio-centros y esta flexibilidad puede subyacer parcialmente la capacidad de los CPGs para producir múltiples patrones de salida.
Bullock, T.H. The origin of patterned nervous discharge. Behaviour 17: 48–59, 1961.
Hughes, G.M., and C.A.G. Wiersma. The co-ordination of swimmeret movements in the crayfish, Procambarus clarkii. J. Exp. Biol. 37: 657-670, 1960.
Marder, E., and R.L. Calabrese. Principles of rhythmic motor pattern production. Physiological Reviews 76: 687–717, 1996.
Skinner, F.K., N. Kopell, and E. Marder. Mechanisms for oscillation and frequency control in reciprocal inhibitory model neural networks. Journal of Computational Neuroscience 1: 69–87, 1994.
Van Vreeswijk C, L.F. Abbott, and G.B. Ermentrout When inhibition not excitation synchronizes neural firing. Journal of Computational Neuroscience 1: 313–321, 1994.
Wilson D.M. The central nervous control of flight in a locust. J. Exp. Biol. 38: 471-490, 1961.