La forma mas fisiológica de estudiar las funciones cerebrales es hacerlo en animales despiertos y comportándose lo mas normalmente posible. Estas técnicas fueron desarrolladas por H. Jasper y claboradores hasta 1958 y aplicadas al estudio del comportamiento de las llamadas motoneuronas superiores y el movimiento en los primates por E. Evarts en 1968. Posteriormente, en los 1970s, las neuronas en la llamada área motora primaria I fueron el foco de atención, pero no fue sino hasta los 1980s que Georgopoulos y colaboradores demostraron la utilidad de explorar el movimiento de las extremidades para alcanzar un objeto y examinar como se relaciona este comportamiento motor con la actividad de una población de neuronas.

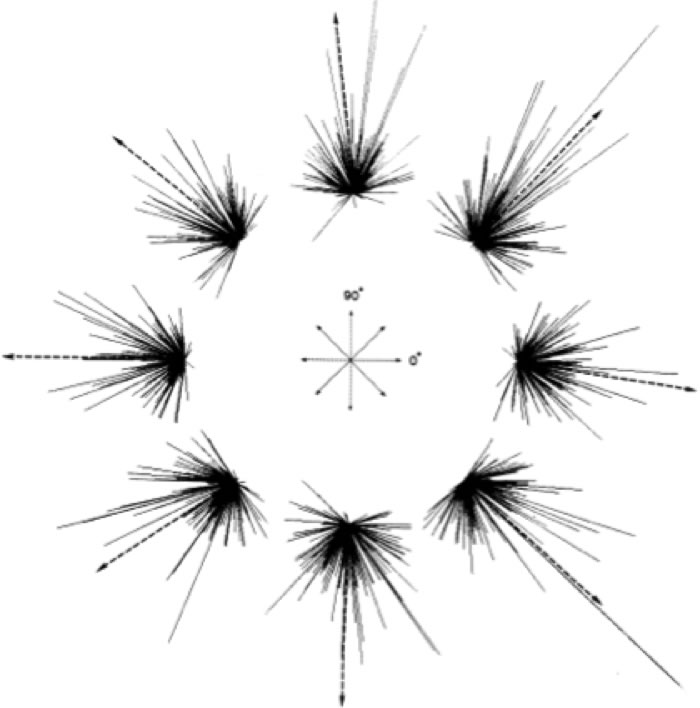
Figura 1. Algoritmo del vector de población. La respuesta de cada neurona en una población durante los movimientos hacia un blanco está representada por un vector en la dirección preferida por la unidad, evaluada (longitud) con la frecuencia de activación de la unidad durante el movimiento (Georgopoulos et al., 1983).
Para estudiar la relación entre el área motora M1 y la dirección del movimiento de la mano, Georgopoulos y colaboradores (1983) introdujeron el método del vector de población. En este método cada neurona 'vota' por una dirección de movimiento activándose en forma máxima (máxima frecuencia de descarga para una dirección dada) y los votos (vectores neuronales) son sumados para crear el 'vector de población'. En esos primeros trabajos pareció que el vector tendía a apuntar en la dirección del movimiento de la mano (Georgopoulos et al., 1983), aunque trabajos subsecuentes parecen sugerir que el vector refleja mas bien la velocidad del movimiento (Schwartz, 1993).
Entonces, ¿qué significa que el vector de población apunte en la dirección del movimiento? Puede significar varias cosas: 1) que las neuronas en M1 especifiquen la información global sobre la calidad del trabajo motor relacionado a la dirección del movimiento (8); 2) que la actividad neural pueda generar un vector de población que apunte en la dirección del movimiento si se llenan tres condiciones, a) que la sintonía neruronal sea simétrica, b) que haya una distribución uniforme de direcciones preferidas a través de la célula muestreada y, c) que no haya acoplamiento entre la dirección preferida de una neurona y cuanto modula su actividad durante el movimiento (Mussa-Ivaldi, 1988; Todorov, 2000; Sanger, 2003).
Sin embargo, eso no significa necesariamente que las neuronas estén codificando el movimiento de la mano y trabajos recientes en monos que hacen movimientos con el brazo en un plano horizontal, muestra que los vectores de población basados en la actividad de M1 no siempre predicen la dirección del movimiento de la mano (Scott et al., 2001); esto es, pueden estar desviados hacia una de dos direcciones, hacia la izquierda alejándose del cuerpo o hacia la derecha acercándose al cuerpo. Así, la longitud de los vectores de población puede variar a lo largo de las direcciones de movimiento, aunque sean similares en magnitud y tengan las mismas velocidades máximas de la mano.
La razón por la que los vectores de población no predicen la dirección del movimiento es que la distribución de direcciones preferidas no es uniforme. Las neuronas tienden a tener direcciones preferidas, ya sea alejándose a la izquierda o acercándose hacia la derecha y esto parece deberse, al menos parcialmente, a la anisotropía mecánica de la extremidad; esto es, se requiere mas potencia mecánica para iniciar el movimiento de las extremidades en esas dos direcciones, comparados con las direcciones en los otros dos cuadrantes cartesianos.
Estos resultados tienen gran relevancia para el campo de la neuroprostética (Scott, 2001, 2008), ya que el objetivo de esos estudios es utilizar señales nerviosas, como el registro simultáneo de neuronas en M1, para controlar robots o reanimar miembros paralizados. Una característica notable que se vió en el trabajo de Graziano y colaboradores (2002a, 2002b) es que la estimulación de un sitio cortical particular siempre resulta en movimientos que llevan a la misma postura final, independientemente de la configuración inicial de las extremidades; por ejemplo, un movimiento de la mano a la boca, ya sea que la posición inicial de la mano esté a la izquierda, derecha o frente al animal. Entonces, ¿la actividad de las neuronas individuales en la corteza motora primaria refleja esas posiciones finales? El trabajo de Caminiti y colaboradores (1990) sugiere que la actividad neural durante los movimientos no refleja esas posiciones de equilibrio y que los primates no-humanos hacen movimientos de alcanzado en diferentes direcciones espaciales, pero a partir de una de tres posiciones de la mano (izquierda, derecha o central). Ellos encontraron que la mayor parte de las neuronas estaban sintonizadas en forma gruesa a la dirección del movimiento para aquellos iniciados desde cada lugar espacial. Aunque había algunos cambios en la sintonía direccional de las neuronas entre las posiciones iniciales de la mano, estos cambios parecían mantener una orientación constante relativa a la orientación del cuerpo o del hombro. Mas aún, trabajos recientes han mostrado que hay poca similitud en la sintonía direccional de las neuronas en un solo lugar en M1, sin evidencias de una representación organizada de la dirección del movimiento en la superficie cortical (Ben Shaul et al., 2003).
En resumen, la actividad nerviosa en M1 no refleja un sólo marco coordinado o representación. Mas bien, la actividad nerviosa refleja muchas característias del trabajo motor, desde los objetivos de alto nivel hasta los detalles de bajo nivel de la ejecución motora. Además, esta representación compleja de la actividad motora en M1 no sorprende si uno considera el gran número de regiones corticales y subcorticales que proyectan e influencían la actividad motora cortical, así como el papel importante de M1 para influir sobre el tallo cerebral y la circuitería espinal en el control del movimiento.
Ben Shaul, Y., E. Stark, I. Asher, R. Drori, Z. Nadasdy, and M. Abeles. 2003. Dynamical organization of directional tuning in the primate premotor and primary motor cortex. J. Neurophysiol. 89: 1136-1142.
Caminiti, R., P.B. Johnson, and A. Urbano. 1990. Making arm movements within different parts of space: dynamics aspects in the primate motor cortex. J. Neurosci. 10: 2039-2058.
Evarts, E.V. 1968. Relation of pyramidal tract activity to force exerted during voluntary movements. J. Neurophysiol. 31: 14-17.
Georgopoulos, A.P. 1995. Current issues in directional motor control. Trends Neurosci. 18: 506-510.
Georgopoulos, A.P., J.F. Kalaska, R. Caminiti, and J.T. Massey. 1983. Spatial coding of movement: a hypothesis concerning the coding of movement direction by motor cortical populations. Exp. Brain. Res. 7 (Suppl.): 327-336.
Graziano, M.S., C.S. Taylor, and T. Moore. 2002a. Complex movements evoked by microstimulation of precental cortex. Neuron 34: 841-851.
Graziano, M.S., C.S. Taylor, T. Moore, and D.F. Cooke. 2002b. The cortical control of movement revisited. Neuron 36: 349-362.
Haggard, P. 2009. The sources of human volition. Science 324: 731-733.
Jasper, H.H., L.D. Proctor, R.S. Knighton, W.C. Moshay, R.T. Costells. 1958. Recent advances in our understanding of ascending activities of the reticular system. In: Reticular Formation of the Brain. Little and Brown, Boston. pp. 423–434
Mussa-Ivaldi, F.A. 1988. Do neurons in the motor cortex encode movemente direction? An alternative hypothesis. Neurosci. Lett. 91: 106-111.
Sanger, T.D. 2003. Neural population codes. Curr. Opin. Neurobiol. 13: 238-249.
Schwartz, A.B. 1993. Motor cortical activity during drawing movements: population representation during sinusoid tracing. J. Neurophysiol. 70: 28-36.
Scott, S.H., P.L. Gribble, K.M. Graham, and D.W. Cabel. 2001. Dissotiation between hand motion and population vectors from neural activity in motor cortex. Nature 413: 161-165.
Scott, S.H., 2008. Cortical-based neuroprosthetics: when less may be more. Nature Neuroscience 11: 1245-1246.
Todorov, E. 2000. Direct cortical control of muscle activation in voluntary arm movements: a model. Nat. Neurosci. 3: 391-398.