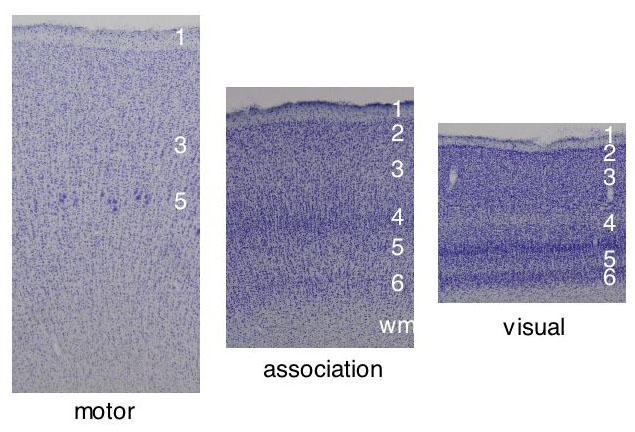
La corteza cerebral en la región que cubre la neocorteza y tiene un grosor de 2-4 mm, con una estructura de 6 capas, tres superficiales (I-III) y tres profundas (IV-VI). También tiene columnas funcionales de una fracción de milímetro en diámetro, que se extienden a través de la profundidad de la corteza.
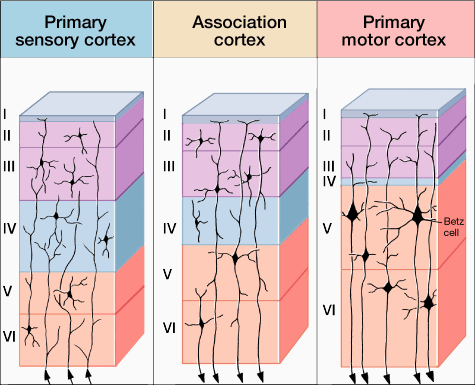
Como todas las regiones de la neocorteza, la corteza motora primaria tiene seis capas y a diferencia de las áreas sensoriales primarias, es agranular; esto es, no tiene una capa granular con muchas células. En vez de eso, la capa mas distintiva de la corteza motora primaria es la de salidas descendientes (capa 5), que contiene las células gigantes de Betz. Estas células piramidales y otras neuronas de proyección de la corteza motora primaria, contribuyen hasta con el 30% de las fibras del tracto corticoespinal, mientras el resto de las fibras provienen de la corteza premotora y el área motora suplementaria (~30%), la corteza somatosensorial (~30%) y la corteza parietal posterior (~10%).


Fig. 4. Las seis capas de varias regiones de la corteza. Notese que las capas de las diferentes regiones de la corteza no tienen el mismo grosor y que las grandes células piramidales están en la capa V y VI de la corteza motora primaria.
La capa I es llamada molecular y tiene pocas neuronas, fundamentalmente interneuronas. En cambio, contiene numerosas dendritas y axones de neuronas que se encuentran en capas profundas.
La capa II es llamada piramidal externa y está formada principalmente por células granulares y dendritas apicales de neuronas cuyos somas están localizados en las capas V y VI. Las neuronas de la capa II son principalmente pequeñas células piramidales e interneuronas GABAérgicas, y las capas II y III proporcionan la mayor parte de las salidas a otras regiones corticales.
La capa III es llamada piramidal externa y contiene una variedad de células, la mayor parte de ellas células piramidales que usan como trasmisor los aminácidos excitatorios aspartato y glutamato. Las capas I, II y III conectan regiones corticales adyacentes e integran varias funciones corticales.
La capa IV se conoce como granular interna porque contiene células granulares que pertenecen a plexos locales, en canasta y candelero, siendo todas ellas neuronas inhibitorias. En esta capa se encuentran también células estrelladas espinosas. Semeja a la capa II en que tiene numerosas células estrelladas y recibe la mayor parte de las señales sensoriales.
La capa V es llamada piramidal interna, porque el tamaño del soma de las neuronas piramidales aumenta hacia adentro. Está formada principalmente por grandes células piramidales, aunque también contiene dendritas basales de neuronas en las capas III y IV. Al menos los axones y posiblemente las dendritas basales de células bipolares no-espinosas se encuentran en esta capa, así como células de plexos locales. Hay dos tipos de células bipolares no-espinosas, una de las cuales es inhibitoria y la otra parece ser excitatoria. En esta capa se encuentran las células en candelero. La capa V contiene las células piramidales mas grandes, que proyectan grandes axones que descienden a los ganglios basales, tallo cerebral y médula espinal.
La capa VI es una capa heterogénea de neuronas fusiformes arregladas perpendicularmente a la superficie cortical y mezcladas con substancia blanca. También contiene dendritas basales de neuronas en las capas III y IV. Muchas células piramidales de esta capa proyectan al tálamo.
Con base en las propiedades de sus señales, la mayor parte de las neuronas corticales pueden ser clasificadas en cuatro grupos; neuronas que producen, a) espigas regulares; b) espigas rápidas; c) descargas intrínsecas y; d) descargas contínuas. Las neuronas excitatorias de las capas superficiales tienden a ser del tipo espigas regulares, mientras las capas profundas contienen neuronas excitatorias de los tipos espigas regulares o descargas contínuas. El 50% de las interneuronas inhibitorias en la neocorteza son del tipo espigas rápidas.
A lo largo de los años se han propuesto varios modelos para explicar la organización de los circuitos corticales, aunque muchas de las conexiones corticales son hipotéticas debido a la gran cantidad de estudios anatómicos que se requieren para establecer cada una de ellas.
Uno de los primeros modelos fue propuesto por Sheperd (1978), quien indica que algunas neuronas piramidales de las capas II y III retroalimentan las señales de salida a sus propias dendritas. Shepherd propone que la organización neocortical sigue el marco general mostrado en otras regiones del cerebro, en particular en la corteza olfatoria y el hipocampo. La 'corteza simple' es modelada con base en la corteza olfativa, pero este modelo ha sido sobrepasado.
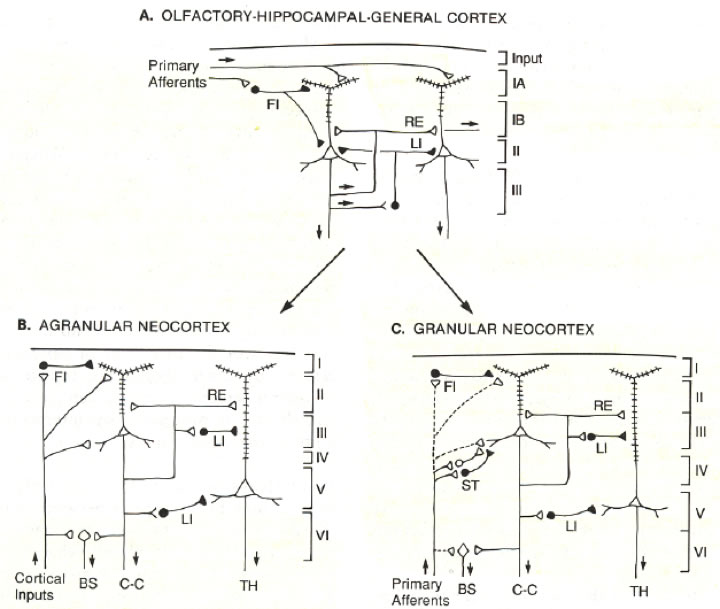
Figura 1. Principios de organización de los circuitos locales en la corteza cerebral. A. Corteza simple, como se representa por la corteza olfativa, hipocampo y corteza reptiliana dorsal (general). Las capas están indicadas a la derecha. FI, anteroalimentación inhibitoria; LI, inhibición lateral (y retroalimentación); RE, excitación recurrente (y lateral). B. Neocortezas de asociación motora y agranular. Las capas están a la derecha y los sitios de salida abajo. C-C, cortico-cortical; TH, tálamo; C. Areas de asociación y sensorial agranular de la neocorteza. Nótese que la principal diferencia con el circuito en B es la predominancia de aferentes primarias del tálamo, que a través de células estelares (ST) en la capa IV, proyectan a un relevo intracortical. Las conexiones con otras capas aún están presentes, pero son menos prominentes (líneas punteadas). Las conexiones excitatorias se muestran con figuras vacías y las inhibitorias con figuras llenas (Shepherd, 1987).
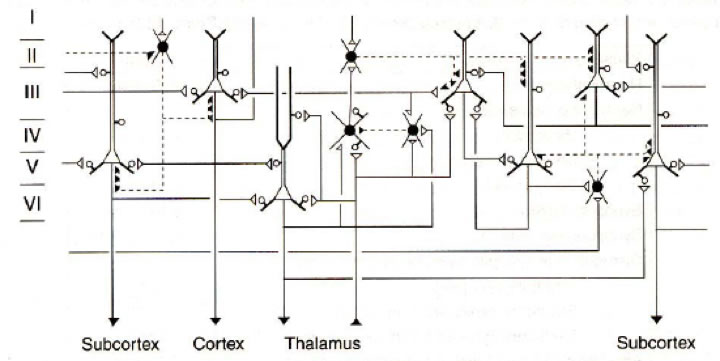
Figura 2. Patrones de conectividad entre neuronas en una capa cortical. Los somas vacíos representan neuronas excitadoras (espinosas) como las neuronas piramidales y las esteladas espinosas. Sus axones tienen líneas sólidas que terminan en triángulos abiertos que representan la terminal del axón. Los botones dendríticos están indicados por circulos vacíos. Las neuronas esteladas (inhibidoras) tienen somas y terminales sinápticas sólidas y los axones están representados por líneas cortadas (Adaptado de Douglas y Martin. En: Synaptic Organization of the Brain, Sheperd, Ed. 1990).
Otro modelo mas reciente fue propuesto por Douglas y Martin y aunque parece mas detallado que el de Shepherd, omite muchas conexiones intra-columnares y muestra sólo tres tipos de neuronas corticales (piramidales, estrelladas espinosas y estrelladas lisas). Igualmente, la relación de células excitatorias a inhibitorias no es correcta, ya que en la corteza sólo el 15% de las células son inhibitorias. Por ello y para corregir esos problemas, White y colaboradores (1989) han propuesto varias reglas generales de organización cortical:
Regla 1. Cada neurona dentro de un área de proyección recibe entradas de esa proyección.
Corolario a la regla 1. Las terminales axónicas de cualquier fuente extrínseca o intrínseca hacen sinápsis con cada tipo morfológico o fisiológico neuronal dentro de su campo de proyección terminal. En la práctica, esto significa que una vía hará sinápsis con cada elemento capaz de formar el tipo de sinapsis normal para la vía (i.e., asimétricas excitadoras o simétricas inhibidoras) en su región blanco.
Regla 2. Las diferentes dendritas de neuronas aisladas formarán patrones sinápticos similares. Esto es, los números, proporciones de tipos y distribución espacial de las sinápsis, siempre será similar a las dendritas que estén expuestas a entradas sinápticas similares.
Corolario a la regla 2. Las vías axonales formarán patrones sinápticos similares sobre todas las dendritas de una sola neurona, siempre que las dendritas se encuentren en la región blanco de la vía axonal.
Regla 3. Los tipos neuronales reciben patrones característicos de conexiones sinápticas; los números reales, proporciones y distribución espacial de las sinápsis formadas por cada tipo neuronal, ocurren dentro de un intervalo de valores.
Corolario a la regla 3. Diferentes vías sinápticas extrínsicas y intrínsecas forman proporciones específicas de sus sinápsis con sus diferentes elementos postsinápticos (espinas versus tallos dendríticos, un tipo de neurona contra otra, etc.).
Regla 4. El campo receptor de cada neurona cortical tiene una forma que depende de la integración espacial y temporal de las entradas de una variedad de fuentes excitatorias e inhibitorias. Las entradas provenientes de una sola fuente no pueden ser el único determinante de las propiedades del campo receptor de las neuronas corticales.
Regla 5. Sólo una fracción de las entradas sinápticas a las neuronas corticales están activas en un momento. Por lo tanto, las propiedades del campo receptor de las neuronas corticales son transitorios y están determinados por los circuitos locales activos en un momento dado.
Regla 6. Las interacciones sinápticas excitatorias e inhibitorias entre las neuronas corticales unen en forma preferencial las neuronas situadas en la cercanía y, en forma típica, estas interacciones unen a neuronas que tienen las mismas propiedades en sus campos receptores. Las interacciones sinápticas entre neuronas cercanas, que tienen propiedadess similares de sus campos receptores, proporcionan la base para la similitud de propiedades de los campos receptores de neuronas dentro de una coluna funcional.
Finalmente, es importante notar que las entradas principales a cualquier columna cortical provienen de otras áreas corticales. Se ha calculado que sólo 1 de cada 100 o incluso 1 de cada 1,000 fibras en la substancia blanca están involucradas en proyecciones subcorticales (tálamo y ganglios basales). El resto de las fibras en la substancia blanca están involucradas en conexiones intra- e inter-hemisféricas de una parte de la corteza a otra.
Se piensa que todas las conexiones inter-columnares son recíprocas; esto es, que un área cortical que recibe entradas de otra área cortical, también manda señales de regreso a esa área y la mayoría de estas conexiones cortico-corticales se hacen entre células piramidales. En contraste, las aferentes piramidales llegan a interneuronas inhibitorias, así como también a neuronas piramidales. Aunque el tálamo proyecta a todas las capas de la corteza, sus proyecciones mas densas se encuentran en las capas IV y VI, donde forman del 5% al 10% de las sinapsis. Además, mas de otras 20 estructuras subcorticales proyectan a la neorcorteza, pero actualmente no tenemos un esquema simple de esas vías, aunque las conexiones monoaminérgicas son moduladoras mas que señaladoras con datos y uno de sus papeles, tal vez el primordial, sea el de modular el nivel de excitación de las neuronas corticales sobre un área relativamente grande que involucra múltiples columnas funcionales.
En 1981 Christoph von der Malsburg propuso una idea que resultó muy especulativa en esa época. Indicó que la representación de un objeto en la neocorteza estaba constituída por un código temporal de actividades de disparo correlacionadas y sincronizadas que involucraban grupos celulares múltiples y reconfigurables. Esta hipótesis no atrajo mucha atención hasta finales de los 1980s y principios de los 1990s, cuando las evidencias experimentales mostraron que las neurons de la neocorteza tienen oscilaciones sincronizadas.
Sobre la base de estudios en pacientes que habían sufrido daño bilateral de las cortezas integrativas rostrales, del lóbulo temporal anterior y de las cortezas de asociación de una sola modalidad sensorial, Damasio propuso que la unión entre entidades y eventos en el cerebro depende de una retroactivación multiregional y fija en el tiempo de pequeños grupos de neuronas que llamó "zonas de convergencia" (Damasio, 1989a, b). En este modelo la propagación de señales es tanto rostro-caudal a partir de cortezas sensoriales hacia los lóbulos frontales, como a la inversa. Las vías convergen nivel por nivel en la zona de redes de convergencia, que retroalimentan a sus fuentes superiores y anteroalimentan a los blancos. Este modelo está en contradicción con el anterior, del flujo de la información caudal a rostral dentro del cerebro, en el que la integración sucesiva de información aumenta en complejidad y detalle conforme se progresa desde áreas poteriores (caudales) del cerebro a áreas frontales (rostrales).
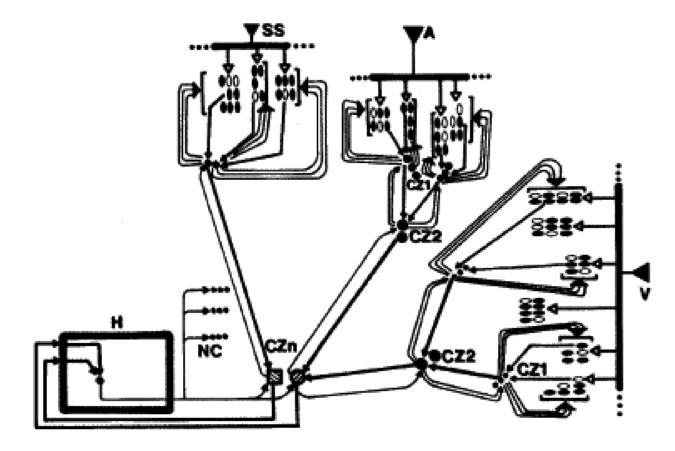
Figura 3. Modelo propuesto por Damasio para explicar la organización neuronal de la corteza cerebral. En esta hipótesis las señales de grupos neuronales superiores convergen sobre pequeños grupos neuronales llamados zonas de convergencia (CZn). Una CZ proporciona señales de retroalimentación directamente a grupos superiores que dirigen la convergencia. Se supone que la retroalimentación rostro-caudal es capaz de re-estimular estas regiones aún en ausencia de estímulos sensoriales directos (por lo tanto proporcionando la capacidad de 'imaginación'). Las CZn también mandan señales hacia adelante, a un CZn de 'nivel superior' que, a su vez, proyecta retroalimentación. Hay mas involucramiento de regiones no-corticales del cerebro (e.g., tallo cerebral) y regiones subcorticales, particularmente del sistema hipocampal. Se supone que las zonas de convergencia producen códigos de unión espacio-temporales que resultan en una actividad sincrónica fija en el tiempo en varias regiones que representan características fragmentarias en las cortezas sensoriales tempranas. Se supone también que los objetos están representados por esta actividad señaladora sincronizada. V=corteza visual; A=corteza auditiva; SS=corteza somatosensorial; NC=núcleos no-corticales; H=sistema hipocampal.
Los modelos propuestos anteriormente para el código temporal utilizaban un esquema muy simple de trenes de pulsos sincronizados y muchos de ellos suponían en forma mas o menos implicita que la sincronización estaba manejada en dirección caudo-rostral, dando poco papel explícito a señales de retroalimentación, que regresaban a las cortezas sensoriales iniciales. Debido a limitaciones tecnológicas de aquel tiempo, los modelos de sincronización tenían que ser inferiridos a partir de registros de unidades aisladas y la actividad de las poblaciones de neuronas era derivada a partir de estos datos. La mayor parte de las consideraciones iniciales dirigidas a los modelos de sincronización se ajustaban al punto de vista de las neurociencias tradicionales, en las que el proceso de información en el cerebro es jerárquico en dirección caudo-rostral. Aunque se sabía que las conexiones neerviosas de retroalimentación eran comunes en la corteza, aún así se suponía que la representación de objetos y eventos ocurría principalmente por medio de una organización anteroalimentaria. Naturalmente, esta hueva hipótesis de 'sincronización por unión' no fue aceptada inmediatamente, pero ha sido probada por medio de experimentos psicológicos y registros de espigas. Sin embargo, varios investigadores no han aceptado esos resultados (Fahle and Koch, 1995; Ghose and Freeman, 1992; Kiper et al., 1996; Leonards et al., 1995), mientras otros han criticado a estos últimos (Fries et al., 1997; Kottmann and Eckhorn, 1996; Kruse and Eckhorn, 1996).
Es curioso que la hipótesis de Damasio no haya sido trabajada por experimentalistas. Aunque ha sido aceptado que dos áreas cualesquiera de la corteza cerebral que mandan señales una a otra lo hacen en forma recíproca y a pesar de los datos experimentales, no ha habido un esfuerzo concentrado para confirmar o refutar la hipótesis de las zonas de convergencia.
Hay numerosas evidencias experimentales de la existencia de fenómenos ondulatorios manejados por osciladores en la neorcorteza y, por supuesto, la existencia de osciladores como los generadores centrales de patrones ha sido reconocida hace mucho tiempo. Mucho del trabajo en esta área ha sido hecho en invertebrados o en regiones subcorticales del cerebro de vertebrados, pero la confirmación de mecanismos oscilatorios en la neocorteza y la evidencia de ondas de actividad viajera es mas reciente. En una tradición desarrollada a partir de métodos EEGs, en forma típica los fenómenos oscilatorios se dividen en bandas: 1) banda de baja frecuencia (0-3.5 Hz); 2); banda alfa (7-14 Hz); banda teta (14-28 Hz) y; 4) banda gama (28-80 Hz).
La siguiente figura ilustra una onda viajera en la banda gama de la corteza visual del mono (Gabriel and Eckhorn, 2003). Estos datos fueron registrados con un arreglo lineal de microelectrodos espaciados por 0.5 mm y filtrados en el intervalo 30-70 Hz (banda gama).
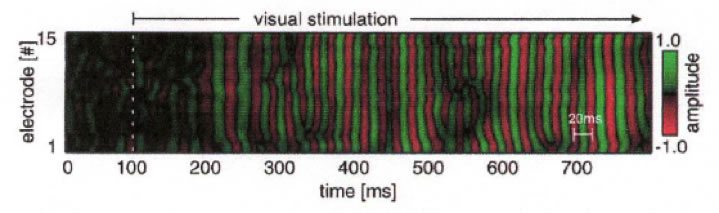
Figura 4. Registro de 15 canales de señales en la banda gama de la corteza estriada de un mono despierto. Los datos fueron registrados con un arreglo lineal de microelectrodos espaciados cada 0.5 mm y el estímulo visual fue aplicado a los 100 mseg. Los autores interpretan estos resultados como indicativos de un amplio frente de onda, supuestamente una onda viajera que llega simultáneamente a los 15 diferentes microelectrodos. (Gabriel and Eckhorn, 2003)
Damasio, A.R. Time-locked multiregional retroactivation: A systems-level proposal for the neural substrate of recall and recognition. Cognition 33: 25-62, 1989a.
Damasio, A.R. The brain binds entities and events by multiregional activation from convergence zones. Neural Computat. 1: 123-132, 1989b.
Douglas, R., and K. Martin. Neocortex. In: The Synaptic Organization of the Brain. 4th ed., G.M. Shepherd (ed). Oxford, UK: Oxford University Press, 1998. pp. 459-509.
Fahle, M., and C. Koch. Spatial displacements, but not temporal asynchrony, destroys figural binding. Vis. Research. 35: 491-494, 1995.
Fries, P., P.R. Roelfsema, A.K. Engel, P. König, and W. Singer. Synchronization of oscillatory responses in the visual cortex correlates with perception in interocular rivalry. Proc. Nat. Acad. of Sci. USA. 94: 12,699-12,704, 1997.
Gabriel, A. and R. Eckhorn. A multi-channel correlation method detects traveling γ-waves in monkey visual cortex. J. Neurosci. Methods. 131: 171-184, 2003.
Ghose, G.M. and R.D. Freeman. Oscillatory discharge in the visual system: Does it have a functional role?. J. Neurophysiol. 68: 1558-1574, 1992.
Kiper, D.C., K.R. Gegenfurtner, and A. Movshon. Cortical oscillatory responses do not affect vision segmentation. Vis. Research. 36: 539-544, 1996.
Kottmann, M. and R. Eckhorn. Perception related synchronized oscillations in monkey striate cortex in a binocular rivalry task. Soc. Neurosci. Abstract. 22: 255.10, 1996.
Kruse, W. and R. Eckhorn. Inhibition of sustained gamma oscillations by fast transient responses in cat visual cortex. PNAS, USA. 93: 6112-6117, 1996.
Leonards, U., W. Singer, and M. Fahle. The influence of temporal phase differences on texture segmentation. Vis. Research. 36: 2689-2697, 1995.
Shepherd, G.M. Microcircuits in the nervous system. Sci. Amer. 238: 92-103, 1978.
Shepherd, G.M. Neurobiology, 3rd ed., Oxford, UK: Oxford University Press, 1994.
von der Malsburg, C. The correlation theory of brain function. In: Models of Neural Networks II: Temporal aspects of coding and information processing in bilogical systems. E. Domany, J.L. van Hemmen and K. Schulten (eds.), pp. 95-119. NY: Springer-Verlag, 1994.
White, E.L. Cortical Circuits: Synaptic Organization of the Cerebral Cortex, Structure, Function, and Theory. Boston, MA: Birkhäuser, 1989.
Eckhorn, R., “Neural mechanisms of visual feature binding investigated with microelectrodes and models,” Visual Cognition, vol. 6 (3/4), pp. 231-265, 1999.