
Hacia el final de los años 1800s el mecanismo químico que subyace el intercambio de mensajes entre células nerviosas y musculares era un gran misterio, por lo que es extraordinario que Ludimar Hermann, uno de los estudiantes de du Bois Reymond, haya sido capaz de concluir que las células nerviosas y musculares generan una 'onda de negatividad auto-propagada que avanza a lo largo del tejido'. En este vacío de conocimiento varios físicos de la escuela alemana intentaron proporcionar una explicación física y química para los procesos de la vida y uno de ellos fue Julius Bernstein. Bernstein hizo la primera contribución teórica real postulando la teoría iónica, la ecuación de Nernst, y la suposición de que existía una membrana semi-permeable rodeando las células nerviosas y musculares, lo que explicaría las evidencias electrofisiológicas del pasado.
El postulado de Bernstein era que las diferencias en las concentraciones de potasio (K+) dentro y fuera de la célula explicarían la presencia del entonces ya bien conocido fenómeno del potencial de reposo de la membrana. Ya en los 1880s Sidney Ringer había perfundido con agua los vasos de un corazón aislado de rana, descubriendo que para que continuara latiendo necesitaba añadir sales; específicamente, sodio, potasio y calcio, que tenían que estar en cierta relación de concentración.
También había ya una explicación razonable para las observaciones de Carlo Matteucci de los 1830s, cuando disecó tejido muscular de rana y al exponerlo a una tóxina que producía tétanos, encontró que su capacidad para contraerse disminuía mucho y que proporcionaba menos descargas eléctricas. De alguna manera, la tóxina del tétanos influía sobre el flujo de iones hacia dentro y fuera de las células musculares. Lo que todavía faltaba por explicar acerca del fenómeno eléctrico de los nervios y músculos, era cómo y porqué los iones podían entrar y salir de las células nerviosas y musculares.
Otro problema era que tanto las neuronas de rana como de mamíferos tienen diámetros muy pequeños, comparadas con las de algunos animales marinos y para medir el potencial de membrana desde el interior de la célula el electrodo tendría que ser muy pequeño y la neurona relativamente grande, mucho mas de lo que entonces se conocía.
El primer anatomista que se dió cuenta de que los axones gigantes del calamar podían ser útiles para estudiar los fenómenos eléctricos de la membrana fue John Zaccary Young en 1937. Estos axones son muy convenientes para esos estudios porque además de que están casi completamente aislados, son entre 100 y 1,000 veces mayores en diámetro que los axones de otros animales, por lo que es posible tener acceso al medio interno. Así, la facilidad de trabajar con axones de gran diámetro permitió por primera vez hacer registros intracelulares del potencial de acción y obtener las primeras mediciones de las corrientes iónicas que lo producen.
Durante experimentos usando axones gigantes de calamar, Alan L. Hodgkin y Andrew F. Huxley reemplazaron los iones sodio del exterior y con ello pudieron demostrar que el potencial de acción se debía a la entrada de estos iones. Encontraron que el potencial de acción no se generaba en ausencia de iones sodio en el exterior del axón, pero si la concentración se aumentaba gradualmente, la amplitud del potencial también aumentaba. Con esto quedó claro que la forma como las neuronas producen y conducen mensajes a lo largo de los axones es permitiendo la entrada de iones sodio al interior; sin embargo, entonces todavía no se sabía que la membrana celular tenía canales para estos iones, de manera que quedaban dudas sobre cómo entraban los iones a la célula.
El siguiente paso que permitió descifrar los secretos del potencial de acción fue en la instrumentación, cuando Kenneth S. Cole inventó la técnica conocida como 'control de voltaje', que requiría colocar dos electrodos dentro de la célula, uno para medir el voltaje y otro para inyectar la corriente necesaria para controlar el voltaje a través de la membrana. Como la corriente que se necesitaba inyectar para mantener el potencial de la membrana en un valor constante era igual, pero de signo opuesto a la que cruza la membrana, esto hizo posible medir las corrientes iónicas que producen los cambios de voltaje que ocurren durante el potencial de acción. En esta forma se pudieron demostrar los efectos producidos sobre el voltaje por las corrientes de entrada de sodio y de salida de potasio.
Después, el trabajo de Bernard Katz y John C. Eccles mostró que los canales iónicos eran fundamentales para la trasmisión de las señales a través de las sinapsis químicas, aunque en este caso los canales están regulados por moléculas, como acetilcolina, mas que por cambios en los voltajes de la membrana. Posteriormente, en los 1960s y 1970s, se descubrieron otras moléculas que ayudan a regular estos canales, como el glutamato, GABA, glicina, serotonina, dopamina y noradrenalina y actualmente ya se han encontrado cerca de 100 de estas moléculas con efectos sobre los fenómenos eléctricos de las membranas neuronales.
Una de las tóxinas mas útiles para caracterizar las corrientes iónicas ha sido la tetrodotóxina (TTX), un alcaloide neurotóxico aislado del pez globo. Se encontró que la TTX bloqueaba exclusivamente el canal para el sodio y poco después también se encontró que la molécula de tetraetilamonio (TEA) bloqueaba el canal para el potasio, lo que proporcionó evidencias de la existencia de canales independients para el sodio y el potasio. Para 1955 a estos datos se añadieron los resultados obtenidos con trazadores radioactivos, como el potasio, que finalmente eliminaron toda duda sobre la existencia de canales específicos a través de la membrana para el paso de los iones.
A principios de los 1970s se descubrió 'ruido eléctrico' en la sinapsis neuromuscular, que fue interpretado como debido a la apertura y cierre de canales individuales que eran controlados por la unión de la acetilcolina. En la misma época Stephen B. Hladky y Denis A. Haydon encontraron que añadiendo el antibiótico gramicidina a bicapas artificiales podían registrar 'escalones' en la conductancia de la membrana y los interpretaron como la apertura de los canales que se abrían y cerraban para dejar pasar los iones.
Hasta los 1970s los biofísicos sólo podían estudiar los canales iónicos registrando las llamadas 'corrientes macroscópicas' producidas por la apertura y cierre de decenas o centenares de canales, pero en 1976 Erwin Neher y Bert Sackman desarrollaron el llamado 'patch-clamp'. Esto permitió distinguir los diferentes canales y pronto se encontró que pueden agruparse en tres categorías de acuerdo a su dependencia para la apertura, del voltaje transmembrana, de un ligando extracelular o de un ligando intracelular.
Para los 1980s se encontró que no todos los canales son regulados directamente, ya que los receptores metabotrópicos los activan por medio de segundos mensajeros, como cGMP, cAMP o IP3. Un ejemplo de estos últimos es la proteina llamada rodopsina que se encuentra en los fotoreceptores del ojo, pero en el epitelio olfativo hay mas de 1,000 receptores de este tipo que activan los canales iónicos en forma indirecta y son responsables de nuestro sentido del olfato. Una diferencia importante entre estos canales y aquellos de los que dependen las señales eléctricas, es que en los primeros los receptores permiten que los canales permanezcan abiertos por periodos de tiempo largos, entre segundos y minutos, mientras que los canales activados directamente están abiertos sólo por milésimas de segundo. De hecho, se ha demostrado que algunos de los canales que se abren en forma indirecta pueden permanecer abiertos por días y se especula que probablemente esto es importante para la formación de las memorias de largo plazo.
A finales de los 1970s, con la tecnología del DNA recombinante hubo otra revolución en el estudio de los canales iónicos, ya que proporcionó los mecanismos para secuenciar la información genética de las proteinas que los forman y también producir grandes cantidades de la proteina en organismos fáciles de crecer, como las bacterias E. coli. Entonces los investigadores ya no tuvieron que depender de tejidos naturales para obtener los canales iónicos y usando técnicas de 'cross-linking' y otras, para 1980 se había encontrado que los canales consisten de mas de una sola subunidad de proteina.
Por ejemplo, el 'nicotinic-acetilcholine-receptor' (nAChR), que es el canal para el sodio que se encuentra en las células musculares y se abre cuando se le une la aceticolina, consiste de 5 subnidades con un peso molecular total de 290 KDa (el D, Da o Dalton, es la unidad de peso de las moléculas y equivale al peso de un átomo de hidrógeno). Para 1982 se determinó su secuencia de aminoácidos (también llamada 'estructura primaria' de la proteina) y con esto fue posible predecir como se verían los canales en tres dimensiones, lo que empezó a hacerse inmediatamente, ya que para entonces las computadoras tenían la capacidad de memoria y velocidad suficiente.
Otra ventaja de conocer el gene de un canal iónico es que por medio de la técnica conocida como 'site-directed mutagenesis', se puede cambiar en forma deliberada la secuencia. El canal iónico nAChR fue el primer canal purificado y reconstituído en una membrana lipídica artificial y cuya actividad se midió, pero también fue el primer canal que en 1984 se expresó en céulas diferentes a la nativa por medio de la inyección de su mRNA (Mishina et al., 1984) y el primero cuya conductancia fue medida por medio del 'patch-clamp' (Neher y Sackman, 1986).
En 1987 se encontró en la mosca Drosophila melanogaster un gene que codifica un canal para el potasio y hace que se convulsione en forma incontrolable, por lo que fue llamado "shaker" (Tempel et al., 1987). Este gene está dividido en 23 secciones diferentes (exones) que pueden unirse en varias formas ('splice variant') dependiendo del tejido en que se encuentra; por ejemplo, en el ratón hay al menos 12 versiones diferentes conocidas del gene y desde entonces se ha encontrado que cuando las subunidades se combinan en relaciones diferentes, pueden forman versiones diferentes del canal. Esta diversidad no se limita a la estructura del canal, sino también a su función, ya que cada canal tiene propiedades únicas en cuanto a como y cuando es activado. El comportamiento humano equivalente a las convulsiones en Drosophila es llamado "Episodic Ataxia Type-1 (EA-1)" y es un problema neurológico que resulta en movimientos incoordinados que pueden durar segundos o hasta horas.
En 1982 Noda usó la tetrodotoxina, una molécula altamente selectiva, para obtener canales purificados a partir del pez Torpedo; los aisló, clonó y secuenció el canal nAChRl para el sodio y en 1984 también el canal para el sodio dependiente de voltaje de la anguila eléctrica. Entonces se obtuvo parte de la secuencia de aminoácidos y se usó para determinar la de toda la proteina. Antes de 1995 el genoma mas grande secuenciado era el de un virus, el bacteriófago lambda, que consiste de 48,502 pares de bases, pero actualmente ya se ha encontrado el genoma de mas de 25 bacterias, varios eucariotes e incluso del humano.
En 1985 Levitan mostró que la estructura de los canales iónicos puede ser alterada uniendo grupos fosfato a algunos aminoácidos involucrados en su regulación, un proceso 'post-translacional' que altera el funcionamiento del canal mismo. En 1998 Doyle publicó la primera estructura cristalina de un canal iónico con una resolución de 3.2 Å, el canal KscA para el potasio en una bacteria, lo que significa que ya es posible determinar las posiciones exactas de casi todos los átomos individuales en la proteina, que es lo mas cercano a obtener la resolución de la estructura tridmensional de una proteina.
Mientras esos logros proporcionan una gran cantidad de información acerca sobre como se ve el canal, el siguiente paso será determinar como funciona el canal estudiando una serie de estructuras cristalinas de todas sus formas de operación; esto es, básicamente obtener la película de una proteina en acción antes de saber cualquier mecanismo en forma segura. Desde entonces ha habido otros 3 canales iónicos cuya estructura se ha encontrado hasta una resolución atómica.
En esta forma, cuando en 1989 (Rommens et al.) se encontró el gene que produce la fibrosis cística y los códigos genéticos de la proteina fueron llamados "cystic fybrosis transmembrane conductance regulator" (CFTR), se pusieron las bases para la investigación de un nuevo canal y algunas de las preguntas inmediatas que requieren respuesta son: si el CFTR es un canal, ¿qué iones pasan a través de él y a que velocidad?, ¿dónde está localizado el poro y qué tan grande es?, ¿exactamente en qué condiciones se abre y cierra el CFTR?, ¿en qué tejidos se encuentra? y varias otras mas.
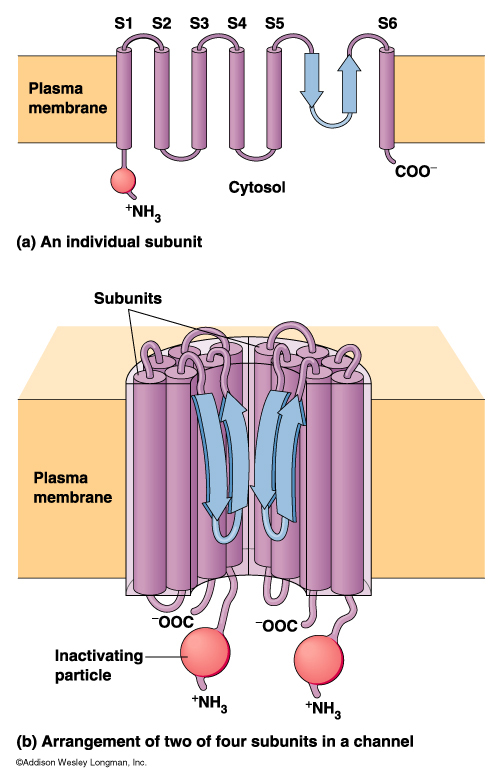
Los iones cruzan la membrana celular a través de canales hechos con proteínas intrínsecas formadas por cuatro a siete subunidades, cuya estructura cuaternaria deja en su centro un poro hidrofílico para los iones.
 |
 |
|---|---|
| Fig. 1. Esquema de la conformación proteica de un canal iónico | Figura 2. Diagrama de un canal para aniones (-) con dos compuertas (amarillo) y filtro de selectividad (cargas rojas). |
Los canales iónicos de la membrana se caracterizan usando sus propiedades mas importantes, que son:
1. Dependencia, ¿qué es lo que abre el canal? Puede ser una molécula (ligando), un cambio de voltaje o una deformación de la membrana;
2. Conductancia, ¿cuál es la conductancia del canal cuando está abierto? Esta es una medida eléctrica del tamaño del poro;
3. Selectividad, ¿qué ión que pasa por el canal con mayor facilidad y por tanto le da su nombre, canal de sodio, de potasio, etc.?
4. ¿Cuál es la rapidéz relativa con la que se abre el canal? Esto hace sospechar en que función podría estar involucrado
La Tabla a continuación muestra algunos de la variedad de canales para el ión K+ y su función.
| Tipo de canal | Destino | Función/Actividad |
|---|---|---|
| Rectificador retardado | Canal para el ión K | Se abre cuando la membrana se depolariza y se inactiva lentamente; repolariza la membrana después del potencial de acción |
| Canal A | Canal KA | Se abre cuando la membrana es depolarizada y tiene una inactivación rápida; influye sobre la excitabilidad de la neurona |
| Canal activado por el Ca2+ | Canal KCa | Se abre en presencia de Ca2+; influye sobre la excitabilidad de la neurona |
| Rectificador hacia adentro | Canal Kir | Se abre cuando la membrana está hiperpolarizada, influyendo sobre la duración del potencial de acción; regula el latido cardíaco |
| Canal M | Canal KM | Se abre cuando la membrana está depolarizada y se inactiva lentamente; es influído por neurotrasmisores |
| Canal S | Canal KS | Normalmente está abierto y se cierra indirectamente en presencia de serotonina; influye sobre la duración del potencial de acción |
| Canal ACh | Canal KACh | Se abre cuando la membrana se expone a acetilcolina; enlentece la frecuencia cardíaca |
Tabla I. Variedad de canales para el ión potasio en la membrana de las células excitables
Generalmente las membranas de los axones tienen tres tipos de canales que utiliza para producir un potencial de acción, aunque algunas neuronas tienen cuatro tipos o mas. Sin embargo, todos los canales tienen variedades, por lo que cada uno puede ser subdividido en varias especies basados particularmente en su dependencia al voltaje transmembrana o a la presencia del ión calcio, como se muestra en la Tabla arriba.
Los canales mas comunes en las neuronas son:
1. El canal para el sodio, que permite el paso del ión sodio. En forma característica, este canal tiene dos compuertas dependientes del voltaje transmembrana. Cuando la membrana es depolarizada hasta el umbral ambas compuertas son activadas, pero como una de ellas se abre rápidamente mientras la otra se cierra lentamente, el canal permanece abierto menos de 1 milisegundo.
2. El canal para el potasio, que tiene sólo una compuerta dependiente del voltaje transmembrana y se abre cuando la membrana se depolariza debido a la entrada de Na+. Se cierra lentamente cuando el potencial de la membrana se hace mas negativo debido a la salida del K+.
3. El canal para el calcio, que también tiene sólo una compuerta y se encuentra en las terminales de los axones; de la entrada de calcio a la terminal axónica depende la liberación de los neurotrasmisores.
4. El canal para el cloro.
Los canales proteicos en la membrana son necesarios para que los iones (principalmente Na+, K+, Ca++ y Cl-) cruzen la membrana generando y propagando las señales con las que los receptores detectan las condiciones del mundo interno y externo al organismo, y el Sistema Nervioso controla sus funciones. Cuando estos canales no funcionan adecuadamente, se producen alteraciones en las funciones del organismo y puede haber diversas enfermedades llamadas canalopatías en general.
Información sobre algunas de las canalopatías mas comunes en el sistema nervioso e identificadas en la práctica clínica puede encontrarse aquí.
Aidley, J. Ion Channels: Molecules in Action. 1996.
Brazier, M.A.B. A History of Neurophysiology in the 19th Century. Raven Press NY, NY. 1988.
Clark, E., and L.S. Jacyna. Nineteenth-Century Origins of Neuroscientific Concepts. University of California Press. 1987.
Doyle, D.A., et al. The structure of the potassium channel: molecular basis of K+ conduction and selectivity. Science 280(5360): 69-77, 1998.
Hille, B. Ionic Channels of Excitable Membranes. Sinauer Associates Inc. Publishers. Sunderland, MA. 1992.
Haydon, D. A., and S. B. Hladky. Ion transport across thin lipid membranes: a critical discussion of mechanism in selected systems. Q. Rev. Biophys. 5: 187-282, 1972.
Levitan, I.B. Phosphorylation of ion channels. J. Membr. Biol. 87(3): 177-190, 1985.
Mishina, M., et al. Expression of functional acetylcholine receptor from cloned cDNAs. Nature. 307: 604-608, 1984.
Neher, E., and B. Sackmann. Single channel currents recorded from membranes of denervated frog muscle fibers. Nature 260: 799-802, 1986.
Noda, M., et al. Primary structure of α-subunit precursor of Torpedo californica acetylcholine receptor deduced from cDNA sequence. Nature 299: 793–797, 1982.
Purves, D., et al. Neuroscience. Sinauer Associates, Inc. Publishers. Sunderland, MA.1997
Rommens, J.M., et al. Identification of the cystic fibrosis gene: chromosome walking and jumping. Science 245 (4922): 1059–65, 1989.
Tempel, B.L., et al. Sequence of a probable potassium channel component encoded at Shaker locus of Drosophila. Science 237(4816): 770-775, 1987.